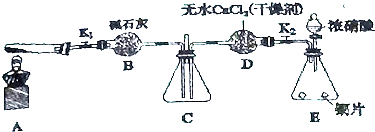
题目内容
5.设NA为阿佛加德罗常数(1)4.9g硫酸中含有0.1mol H原子,0.2NA 个O原子和0.05NA 个S原子,与3.6克H2O中所含O原子数相等,溶于水配成500mL溶液其物质的量浓度为0.1mol/L.
(2)同温同压下,体积相等的CO和CO2的分子数之比为1:1,物质的量之比为1:1,原子数之比为2:3,质量之比为7:11,
(3)某金属氯化物MCl227g,含有0.40molCl-,则该氯化物的物质的量为0.2mol,摩尔质量为135 g/mol,金属M的相对原子质量为64.
分析 (1)4.9g硫酸的物质的量是0.05mol,每个硫酸分子中含有2个H原子、4个O原子,根据N=nNA计算含有O原子数;每个水分子中含有1个O原子,则硫酸和水中O原子个数相等时硫酸和水的物质的量之比为1:4,根据m=nM计算水的质量;根据c=$\frac{n}{V}$计算;
(2)根据阿伏加德罗定律可知,同温同压下同体积的CO2和CO的物质的量相同,根据分子的组成和分子的相对分子质量计算粒子个数以及质量、密度等关系;
(3)根据化学式知,含有0.40molCl-的该化合物物质的量=$\frac{0.4mol}{2}$=0.20mol,M=$\frac{m}{n}$,化合物的相对分子质量等于各元素相等原子质量与原子个数之积的和,据此计算M的相对原子质量.
解答 解:(1)4.9g硫酸的物质的量是0.05mol,每个硫酸分子中含有2个H原子、4个O原子,则0.05mol硫酸分子中含有H原子的物质的量为:0.05mol×2=0.1mol;含有O原子的物质的量为0.05mol×4=0.2mol,根据N=nNA知,含有O原子个数为0.2NA;S原子个数为0.05NA;
每个水分子中含有1个O原子,则硫酸和水中O原子个数相等时硫酸和水的物质的量之比为1:4,水的质量m=nM=0.05mol×4×18g/mol=3.6g;
c=$\frac{n}{V}$=$\frac{0.05mol}{0.5L}$=0.1mol/L;
故答案为:0.1;0.2NA;0.05NA;3.6;0.1mol/L;
(2)根据阿伏加德罗定律可知,同温同压下同体积的CO2和CO的物质的量相同,物质的量之比为1:1,
设CO2和CO的物质的量都为1mol,
则根据N=n•NA可知:气体的分子数之比等于物质的量之比,为1:1;
1个CO中含有2个原子,1个CO2中含有3个原子,则原子数之比为1×2:1×3=2:3,
1molCO的质量为1mol×28g/mol=28g,1molCO2的质量为1mol×44g/mol=44g,质量之比为28:44=7:11,
因CO2和CO的体积相同,则密度之比等于质量之比,为11:7,
故答案为:1:1;1:1;2:3;7:11;
(3)根据化学式知,含有0.40molCl-的该化合物物质的量=$\frac{0.4mol}{2}$=0.20mol,该化合物的摩尔质量M=$\frac{m}{n}$=$\frac{27g}{0.2mol}$=135g/mol,化合物的相对分子质量在数值上等于其摩尔质量,所以该化合物的相对分子质量是135,则R的相对原子质量=135-35.5×2=64,
故答案为:0.2mol;135 g/mol;64.
点评 本题考查物质的量的有关计算,题目难度中等,明确物质的量公式中各个物理量之间关系是解本题关键,注意气体摩尔体积适用范围及适用条件,试题培养了学生的化学计算能力.

| A. | 2Q | B. | Q | C. | 1.8Q | D. | 0.9Q |
| A. | 是否为大量分子和离子的集合体 | B. | 能否通过滤纸或半透膜 | ||
| C. | 分散质粒子的大小 | D. | 是否均一、稳定、透明 |