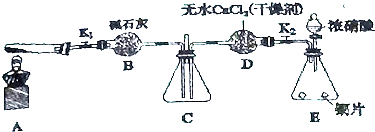
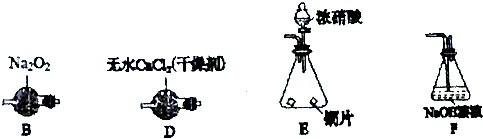
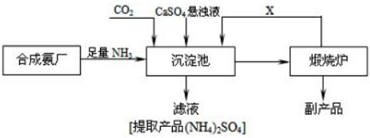
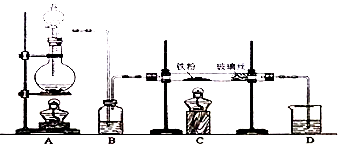
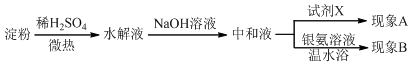
题目内容
4.根据热化学方程式(101kPa) S(s)+O2 (g)═SO2 (g)△H=-297.23kJ/mol 分析下列说法不正确的是( )| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
分析 由S(s)+O2 (g)═SO2 (g)△H=-297.23kJ/mol 可知,为S的燃烧热的热化学方程式,该反应为放热反应,且同种物质的气态比固态能量高,以此来解答.
解答 解:A.由热化学方程式可知,1molS燃烧生成稳定氧化物放出热量为297.23kJ,则S的燃烧热为△H=-297.23kJ/mol,故A正确;
B.同种物质的气态比固态能量高,则S(s)→S(g) 吸收热量,故B正确;
C.同种物质的气态比固态能量高,则S(g)+O2 (g)═SO2 (g) 放出的热量大于297.23kJ,故C错误;
D.反应热等于断裂化学键吸收的能量减去形成化学键释放的能量,该反应为放热反应,则形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量,故D正确;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、燃烧热、键能与焓变的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
9.下列说法错误的是( )
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
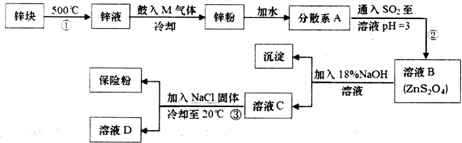
 .分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).
.分散系A为悬浊液(填“溶液”“胶体”或“悬浊液”).