题目内容
已知常温下Ksp[Mg﹙OH﹚2]=a且Mg﹙OH﹚2的饱和溶液中c(Mg2+)=b,则Mg﹙OH﹚2饱和溶液的pH= ﹙用含a,b的代数式表示﹚
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:已知Ksp[Mg﹙OH﹚2]=c(Mg2+)?c(OH-)2=a,c(Mg2+)=b,先计算出氢氧根离子的浓度,再计算氢离子浓度和pH.
解答:
解:已知Ksp[Mg﹙OH﹚2]=c(Mg2+)?c(OH-)2=a,c(Mg2+)=b,
则c(OH-)=
=
,则c(H+)=
=
,
则pH=14+
lg
.
故答案为:14+
lg
.
则c(OH-)=
|
|
| Kw |
| c(OH-) |
| 10-14 | ||||
|
则pH=14+
| 1 |
| 2 |
| a |
| b |
故答案为:14+
| 1 |
| 2 |
| a |
| b |
点评:本题考查了难溶物溶度积的计算及其应用、pH的计算,题目难度中等,明确难溶物溶度积的概念及计算方法为解答关键,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关化学用语错误的是( )
A、乙醇分子球棍模型: | ||
B、8个中子的碳原子的核素符号:
| ||
C、-OH的电子式: | ||
D、CH4Si的结构式: |
下列单体能在一定条件下加聚反应生成 的是( )
的是( )
 的是( )
的是( )| A、丙烯 |
| B、2-甲基-1,3-丁二烯 |
| C、乙烯和丙烯 |
| D、2-甲基-2-丁烯 |
下列反应化学方程式正确的是( )
| A、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O | ||
B、nCH3-CH=CH2
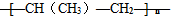 | ||
| C、CH3COO-+HCl→Cl-+CH3COOH | ||
| D、CO32-+CH3COOH→CH3COO-+CO2↑+H2O |
分子式为C8H10O的有机物有多种同分异构体,其中属于醇且苯环上有2个取代基的同分异构体有( )种.
| A、3种 | B、4种 | C、5种 | D、6种 |

