题目内容
下列离子方程式书写正确的是( )
| A、二氧化硫使溴水褪色 SO2+Br2+2H2O=4H++SO42-+2Br- |
| B、用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) CO32-+2H+=CO2↑+H2O |
| C、硫酸铜与Ba(OH)2溶液反应 Cu2++2OH-=Cu(OH)2↓ |
| D、少量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O=CO32-+H2SiO3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.发生氧化还原反应生成硫酸和HBr,遵循电子、电荷守恒;
B.醋酸和碳酸钙在离子反应中均应保留化学式;
C.漏写生成硫酸钡的离子反应;
D.反应生成碳酸钠和硅酸,硅酸在离子反应中保留化学式.
B.醋酸和碳酸钙在离子反应中均应保留化学式;
C.漏写生成硫酸钡的离子反应;
D.反应生成碳酸钠和硅酸,硅酸在离子反应中保留化学式.
解答:
解:A.二氧化硫使溴水褪色的离子反应为SO2+Br2+2H2O=4H++SO42-+2Br-,遵循电子、电荷守恒,故A正确;
B.用食醋清洗热水瓶胆内壁附着的水垢的离子反应为CaCO3+2HAc=CO2↑+H2O+Ca2++2Ac-,故B错误;
C.硫酸铜与Ba(OH)2溶液反应的离子反应为SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.少量CO2通入Na2SiO3溶液的离子反应为CO2+SiO32-+H2O=CO32-+H2SiO3↓,故D正确;
故选AD.
B.用食醋清洗热水瓶胆内壁附着的水垢的离子反应为CaCO3+2HAc=CO2↑+H2O+Ca2++2Ac-,故B错误;
C.硫酸铜与Ba(OH)2溶液反应的离子反应为SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,故C错误;
D.少量CO2通入Na2SiO3溶液的离子反应为CO2+SiO32-+H2O=CO32-+H2SiO3↓,故D正确;
故选AD.
点评:本题考查离子反应方程式的书写,为高频考点,把握发生的化学反应及离子反应中应保留化学式的物质为解答的关键,注意不能漏写离子反应,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、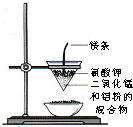 用如图装置制取少量金属锰 |
D、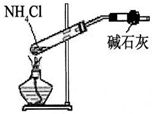 实验室用如图所示装置制取少量氨气 |
下列说法正确的是( )
| A、电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B、氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C、向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D、粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
能说明0.1mol?L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
①稀释时,溶液中c(OH-)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2-)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
| A、①②④ | B、①③④ |
| C、①③ | D、②④ |
以下烃中,一氯化物只有一种的是( )
| A、乙烷 | B、对二甲苯 |
| C、2-甲基丁烷 | D、丙烷 |
下列描述违背化学原理的是( )
| A、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- |
| B、将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性 |
| C、高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强 |
| D、亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应 |
 则△H2
则△H2