题目内容
13.为了回收含有Ag+的废水中的贵重金属,可以向其中加入( )| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
分析 回收含有Ag+的废水中的贵重金属Ag,加入的物质需将银离子还原成银单质,铁能置换出银,活性炭、硫酸亚铁、氯化钠与银离子都不反应,据此分析解答.
解答 解:A.银排在铁的后面,加入铁可以与Ag+反应生成银从而回收银,故A正确;
B.活性炭疏松多孔的结构,具有吸附性,不能与Ag+反应,故不能回收Ag,故B错误;
C.硫酸亚铁中为+2价,不能还原银离子,与Ag+不反应,故不能回收Ag,故C错误;
D.氯化钠中钠离子没有还原性,不能还原银离子,氯化钠与Ag+不反应,故不能回收Ag,故D错误;
故选A.
点评 本题考查了废水的处理,要注意所加的试剂能与Ag+反应且置换出银的原则,题目较简单.

练习册系列答案
相关题目
4.下列物质中,不能由金属单质直接与盐酸反应制得的是( )
| A. | 氯化铝 | B. | 氯化铁 | C. | 氯化亚铁 | D. | 氯化镁 |
1.决定主族元素在元素周期表中所处位置的是该元素原子的( )
| A. | 质量数 | B. | 中子数 | ||
| C. | 次外层电子数 | D. | 电子层数和最外层电子数 |
8.下表是元素周期表的一部分,请回答:
(1)钠元素在元素周期表中的位置是第三周期IA族;
(2)N、O、F三种元素中,非金属性最强的是F(填元素符号);
(3)由上表中两种元素组成的化合物是光导纤维的主要原料,该化合物的化学式为SiO2;
(4)碘与氯是同主族元素.下面关于碘的推断错误的是a(选填字母);
a.常温下,碘单质为气态
b.最高正化合价为+7
C.Cl2通入淀粉KI溶液中出现蓝色
(5)氮的氢化物和氯的氢化物反应生成一种铵盐,常用作氮肥,该反应的化学方程式为NH3+HCl=NH4Cl.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | N | O | F | |||||
| 3 | Na | Si | Cl |
(2)N、O、F三种元素中,非金属性最强的是F(填元素符号);
(3)由上表中两种元素组成的化合物是光导纤维的主要原料,该化合物的化学式为SiO2;
(4)碘与氯是同主族元素.下面关于碘的推断错误的是a(选填字母);
a.常温下,碘单质为气态
b.最高正化合价为+7
C.Cl2通入淀粉KI溶液中出现蓝色
(5)氮的氢化物和氯的氢化物反应生成一种铵盐,常用作氮肥,该反应的化学方程式为NH3+HCl=NH4Cl.
18.下列物质的名称与化学式、分类对应正确的是( )
| A. | 硝酸钠、NaNO2、盐 | B. | 氧化铁、FeO、氧化物 | ||
| C. | 纯碱、Na2CO3、碱 | D. | 酒精、CH3CH2OH、有机物 |
5.下列说法正确的是( )
| A. | 碳酸的酸性比硅酸强 | |
| B. | 136C表示该元素的相对原子质量近似为13,核电荷数为6 | |
| C. | 共价键必然存在于共价化合物中 | |
| D. | X、Y+、Z-三种粒子的电子层结构相同,则其质子数一定不相等 |
3.在高温、高压和有催化剂的恒容密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g).下列叙述正确的是( )
| A. | 降低温度可以加快反应速率 | |
| B. | 使用合适的催化剂可以加快反应的速率 | |
| C. | 在上述条件下,氢气能全部转化为氨气 | |
| D. | 达到平衡时,体系中各物质的浓度一定相等 |


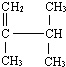 2,3-二甲基-1-丁烯(用系统命名法命名)
2,3-二甲基-1-丁烯(用系统命名法命名)