题目内容
3.已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:(1)该溶液中c(H+)=10-4mol/L.由水电离出的c(H+)=10-10mol/L.
(2)已知MgA2是难溶电解质,则其溶解平衡时的Ksp(MgA2)=c(Mg2+)•c2(A-);
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,稀释后盐酸的pH大于(填“大于”、“小于”或“等于”)HA溶液的pH;
(4)NaA的水溶液显碱性,原因是A-+H2O?HA+OH-(用离子方程式表示).
(5)欲测定某NaOH溶液的物质的量浓度,可用0.1000molL-1HA标准溶液进行中和滴定(用酚酞作指示剂).滴定至终点的颜色变化为溶液由红色变成无色,且半分钟内不褪色.
下列哪些操作会使测定结果偏高AC(填序号).
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
分析 (1)c(H+)=c(HA)×电离度;酸溶液中水电离出的c(H+)等于溶液中c(OH-);
(2)已知MgA2是难溶电解质,则其溶解平衡时的Ksp(MgA2)=c(Mg2+)•c2(A-);
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,盐酸增加两个单位,而HA是弱电解质加水稀释促进HA的电离,所以PH增加不到两个单位;
(4)常温下,NaA为强碱弱酸盐,弱酸根离子水解导致溶液呈碱性;
(5)盛装标准HA的仪器名称为酸式滴定管,滴定终点碱性变中性,所以酚酞溶液由红色变成无色,且半分钟内不褪色;根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.
解答 解:(1)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,由水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,故答案为:10-4mol/L;10-10mol/L;
(2)已知MgA2是难溶电解质,则其溶解平衡时的Ksp(MgA2)=c(Mg2+)•c2(A-),故答案为:c(Mg2+)•c2(A-);
(3)pH=3的盐酸和pH=3的HA溶液各稀释至其体积的100倍,盐酸增加两个单位,而HA是弱电解质加水稀释促进HA的电离,所以PH增加不到两个单位,所以稀释后盐酸的pH 大于HA溶液的pH,故答案为:大于;
(4)常温下,NaA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,水解方程式为A-+H2O?HA+OH-,故答案为:碱;A-+H2O?HA+OH-;
(5)滴定终点碱性变中性,所以酚酞溶液由红色变成无色,且半分钟内不褪色,
A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:溶液由红色变成无色,且半分钟内不褪色;AC.
点评 本题考查了酸碱中和滴定操作、误差分析以及注意事项,溶解平衡的应用,难度不大,应注意相关知识的积累.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| 相关实验 | 预期目的 | |
| A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
| B | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
| C | 室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 | 验证BaSO4和BaCO3的Ksp的相对大小 |
| D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 反应的热化学方程式为2NH4Cl+Ba(OH)2═BaCl2+2NH3•H2O;△H>0 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 氯化铵与氢氧化钡的反应为放热反应 | |
| D. | 该反应中,化学能全部转化为热能 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)B的简单阳离子结构示意图为
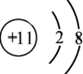 .
.(3)在B、C、D、E、F中,原子半径最大的是Na.
(4)A分别与D、E、G形成的化合物中,最稳定的HF.
(5)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4.呈两性的是Al(OH)3.
| A. | 新制氯水中既有分子,又有离子 | |
| B. | 久置的氯水可以使干燥的有色布条褪色 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水在光照条件下,可以产生气体,该气体是氯气 |
| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
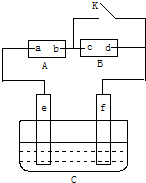 如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: