题目内容
4.下列物质中,不能由金属单质直接与盐酸反应制得的是( )| A. | 氯化铝 | B. | 氯化铁 | C. | 氯化亚铁 | D. | 氯化镁 |
分析 A.根据铝和盐酸的化学性质及反应产物判断;
B.根据铁和盐酸的化学性质及反应产物判断,氢离子氧化性弱和铁反应生成亚铁离子;
C.根据铁与盐酸反应的产物判断,铁和盐酸反应生成氯化亚铁和氢气;
D.根据镁、盐酸的性质及反应产物判断,镁和元素反应生成氯化镁和氢气.
解答 解:A.铝能与盐酸反应生成氯化铝和氢气,能由金属单质直接与盐酸反应制得,故A不符合;
B.铁能与盐酸反应生成氯化亚铁和氢气,而不能生成氯化铁,不能由金属单质直接与盐酸反应制得,故B符合;
C.铁与盐酸反应生成氯化亚铁和氢气,而不能生成氯化铁,故C不符合;
D.镁能与盐酸反应生成氯化镁和氢气,故D不符合.
故选B.
点评 本题主要考查金属和酸的化学性质,熟练掌握物质的性质和反应产物,问题就会迎刃而解,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
14.下列相关实验能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
| B | 可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
| C | 室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 | 验证BaSO4和BaCO3的Ksp的相对大小 |
| D | 相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
15.下列关于氯水的叙述中,正确的是( )
| A. | 新制氯水中既有分子,又有离子 | |
| B. | 久置的氯水可以使干燥的有色布条褪色 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水在光照条件下,可以产生气体,该气体是氯气 |
19.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
(1)反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4-5min原因是此时段c(H+)减小.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是置换出Cu,形成Cu-Zn原电池,使反应更快.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是置换出Cu,形成Cu-Zn原电池,使反应更快.
9.可以用分液漏斗进行分离的混合物是( )
| A. | 酒精和碘水 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙醇和水 |
13.为了回收含有Ag+的废水中的贵重金属,可以向其中加入( )
| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
14.某原电池反应原理示意图如图.下列有关该原电池的说法正确的是( )
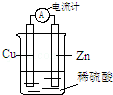

| A. | 将电能转化为化学能 | B. | 一段时间后,铜片质量减轻 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 锌片发生还原反应 |
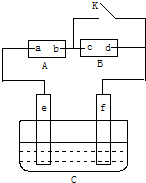 如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: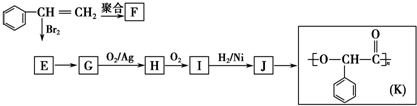
 ;I的结构简式是
;I的结构简式是 .
.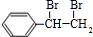 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$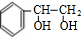 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.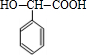 ;反应类型属于加成反应.
;反应类型属于加成反应.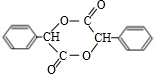 .
.