题目内容
1.决定主族元素在元素周期表中所处位置的是该元素原子的( )| A. | 质量数 | B. | 中子数 | ||
| C. | 次外层电子数 | D. | 电子层数和最外层电子数 |
分析 主族元素的周期序数=电子层数、主族序数=最外层电子数.
解答 解:主族元素在元素周期表中的位置取决于电子层数和最外层电子数,且有关系式:周期序数=电子层数,主族序数=最外层电子数,故选D.
点评 本题考查原子结构与位置关系,比较基础,侧重对基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.可以用分液漏斗进行分离的混合物是( )
| A. | 酒精和碘水 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙醇和水 |
6.现有部分元素的性质与原子(或分子)结构如下表:
(1)写出元素T的原子结构示意图 ;
;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是bd(填序号);
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(3)写出由Y元素最高价氧化物对应的水化物的电子式 ;
;
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式N2H4+2H2O2═N2+4H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是bd(填序号);
a.Y单质的熔点比Z单质低 b.Y单质与水反应比Z单质剧烈
c.Y的化合价比Z低 d.Y最高价氧化物的水化物的碱性比Z强
(3)写出由Y元素最高价氧化物对应的水化物的电子式
 ;
;(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式N2H4+2H2O2═N2+4H2O.
13.为了回收含有Ag+的废水中的贵重金属,可以向其中加入( )
| A. | Fe | B. | 活性炭 | C. | 硫酸亚铁 | D. | 氯化钠 |
10.下列说法正确的是( )
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | Cl2的摩尔质量是71 g/mol | |
| C. | 标准状况下,22.4 L H2O的物质的量为1 mol | |
| D. | 1 mol H2的质量是1 g |
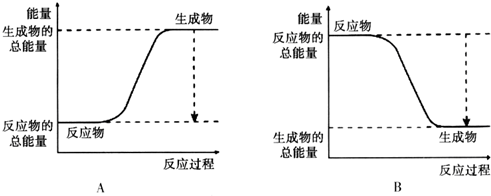
11.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.
(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
在理论上1molO2充分反应生成水放出热量(填吸收或放出)484kJ.
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
(1)为了加快该反应速率,下列措施不可行的是C(填序号,下同).
A.使用催化剂 B.适当提高氧气的浓度
C.适当降低反应的温度 D.适当提高反应的温度
(2)已知该反应为放热反应,如图能正确表示该反应中能量变化的是B.

(3)从断键和成键的角度分析上述反应中能量的变化.
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能.
②化学键的键能:
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O.若电解质溶液为KOH溶液,电极材料为疏松 多孔石墨棒,其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”). 写出氢氧燃料电池工作时正极所发生的电极反应式:O2+4e-+2H2O=4OH-,电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
 如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
 ;I的结构简式是
;I的结构简式是 .
.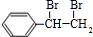 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$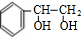 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.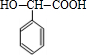 ;反应类型属于加成反应.
;反应类型属于加成反应.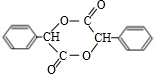 .
.