题目内容
17.实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O(1)在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是2mol,转移电子的物质的量是2mol.
(2)某温度下,将Cl2通入NaOH溶液中,反应得到的混合液中ClO-与ClO3-物质的量之比为1:1,反应的化学方程式是4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O.
分析 (1)根据元素化合价的变化判断,反应中Mn元素的化合价降低,Mn元素被还原,Cl元素化合升高,被氧化,根据化合价变化的数目可确定电子转移的数目;
(2)Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的溶液,根据得失电子守恒配平方程式即可.
解答 解:(1)反应中Mn元素的化合价降低,Mn元素被还原,Cl元素化合升高,被氧化,化合价升高数值=化合价降低数值=转移电子数=2,即有1molCl2生成在消耗的4mol盐酸中,被氧化的HCl的物质的量是2mol,转移电子是2mol,故答案为:2;2;
(2)Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的溶液,即氯元素的化合价升高为+1价和+5价,所以产物还有氯化钠,此时氯元素的化合价降低,ClO-与ClO3-物质的量之比为1:1,即NaClO3和NaClO的系数都是1,即发生的反应为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O,
故答案为:4Cl2+8NaOH=6NaCl+NaClO3+NaClO+4H2O.
点评 本题考查学生氧化还原反应中的基本概念以及氧化还原反应中的化合价变化规律知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
7.宁波气象信息网2011年10月26日13点55分发布环境空气质量实时报告,其中空气污染指数为39,首要污染物为可吸入颗粒物,下列分析不正确的是( )
| A. | 空气质量等级为优 | |
| B. | 二氧化硫的污染指数可能为42 | |
| C. | 目前,我国大部分地区空气中二氧化硫、二氧化氮及可吸入颗粒物等物质的含量偏高 | |
| D. | 对煤、石油等燃料进行脱硫处理、使用氢气等清洁燃料、通过静电沉降器除去悬浮颗粒物都可以治理大气污染,改善空气质量 |
9.日常生活离不开洗涤.下列使用的洗涤剂不正确的是( )
| A. | 用纯碱溶液清洗餐具上的油污 | B. | 用漂白液洗涤衣服上的字迹 | ||
| C. | 用稀硫酸清洗水壶里的水垢 | D. | 用汽油清洗皮肤上的油漆 |
6.${\;}_{6}^{14}$C常用于考古学年代确定.下列关于${\;}_{6}^{14}$C的说法中正确的是( )
| A. | 中子数是6 | B. | 质量数是14 | C. | 电子数是14 | D. | 中子数是14 |
7.常温下,将充满等体积混合气体的试管倒立在水槽中,试管内气体体积不会明显减少的一组是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ |
| NO、O2 | C2Hx、H2 | NO2、O2 | Cl2、SO2 | NH3、O2 | CO、O2 |
| A. | ②⑥ | B. | ②④ | C. | ③⑤ | D. | ①③ |
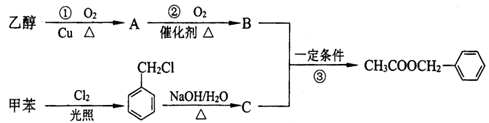
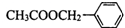 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: