题目内容
9.下列说法不正确的是( )| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氯化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | Fe、Cu分别与Cl2反应,均生成高价氯化物 |
分析 A、光导纤维的成份是二氧化硅;
B、Na的还原性很强,能从钛、锆等金属的氯化物中置换出钛、锆等单质;
C、镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体氧化镁,镁是制造信号弹、焰火、闪光粉、轻质合金原料;
D、氯气是强氧化剂,与变价金属反应生成高价的氯化物.
解答 解:A、光导纤维的成份是二氧化硅,而不是硅,故A错误;
B、钠可用于从钛、铌等金属的氯化物中置换出金属单质,故B正确;
C、镁在空气中点燃,剧烈燃烧,发出耀眼的白光,放出大量的热,生成白色固体氧化镁,镁是制造信号弹、焰火、闪光粉、轻质合金原料,故C正确;
D、氯气是强氧化剂,与变价金属反应生成高价的氯化物,所以氯气与铁、铜反应生成氯化铁和氯化铜,故D正确;
故选A.
点评 本题主要考查了物质的性质与用途,注意知识的积累,难度不大.

练习册系列答案
相关题目
19. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
 已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )
已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,如图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度.下列说法中,不正确的是( )| A. | X表示温度 | B. | L2>L1 | C. | 反应速率 υ(M)>υ(N) | D. | 平衡常数 K(M)>K(N) |
20.在多电子原子中,决定轨道能量的是( )
| A. | 电子层 | B. | 电子层和能级 | ||
| C. | 电子层、能级和原子轨道空间分布 | D. | 原子轨道空间分布和电子自旋方向 |
17.下列物质的水溶液因水解而呈酸性的是( )
| A. | CuCl2 | B. | Na2CO3 | C. | CH3COOH | D. | KHSO4 |
4.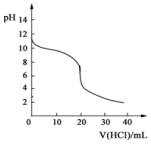 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
 常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的氨水中逐滴加入0.1000mol•L-1的盐酸,pH随盐酸体积的变化如图所示.(不考虑NH3的逸出).下列说法不正确的是( )| A. | 反应过程中:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| B. | V(HCl)=10.00mL时,c(NH4+)>c(Cl-)>c(NH3•H2O) | |
| C. | V(HCl)<20.00mL时,溶液一定呈碱性 | |
| D. | V(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3•H2O) |
14.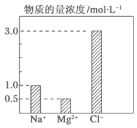 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )| A. | 0.5 mol | B. | 1.0 mol | C. | 2.0 mol | D. | 3.0 mol |
1.实验室里保存下列试剂,其保存的方法和理由,描述都正确的是( )
| 编号 | 试剂 | 保存方法 | 理由 |
| A | 水玻璃 | 存放在带橡皮塞的细口瓶中,密封 | 防止与空气接触被氧化和与二氧化碳接触而变质 |
| B | 硫酸亚铁晶体 | 存放在带玻璃塞的广口瓶中,密封 | 防止与空气接触被氧化 |
| C | 浓硫酸 | 密闭保存 | 防止吸水和挥发 |
| D | 新制的溴水 | 存放在无色试剂瓶中,密封 | 防止挥发 |
| A. | A | B. | B | C. | C | D. | D |
18.下列化学用语的表达正确的是( )
| A. | 硫酸的电离方程式:H2SO4=H2++SO42- | |
| B. | 光导纤维主要成分的化学式:Si | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 钠离子的结构示意图: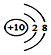 |