题目内容
14.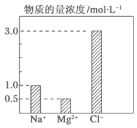 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )| A. | 0.5 mol | B. | 1.0 mol | C. | 2.0 mol | D. | 3.0 mol |
分析 根据n=cV计算n(Na+)、n(Mg2+)、n(Cl-),溶液呈电中性,根据电荷守恒有2n(Ca2+)+n(Na+)+2n(Mg2+)=n(Cl-),据此计算此溶液中Ca2+离子的物质的量.
解答 解:由图可知,溶液中n(Na+)=2L×1mol/L=2mol、n(Mg2+)=2L×0.5mol/L=1mol、n(Cl-)=2L×3mol/L=6mol,
溶液呈电中性,根据电荷守恒可得:2n(Ca2+)+n(Na+)+2n(Mg2+)=n(Cl-),即:2n(Ca2+)+2mol+2×1mol=6mol,
解得:n(Ca2+)=1mol,
故选B.
点评 本题考查物质的量的计算,题目难度不大,注意电解质混合溶液中常利用电荷守恒计算离子浓度或物质的量浓度,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.设NA为阿伏加德罗常数值,下列叙述正确的是( )
| A. | 46gNO2和N2O4混合气体中氮原子数为NA | |
| B. | 1mol 14C含有的中子数为6NA | |
| C. | 标准状况下,22.4LCCl4中含有的分子数为NA | |
| D. | 0.5molNa2O2与足量水反应,转移电子数为NA |
5.分类法是一种行之有效、简单易行的科学方法.某同学用下表所示对所学知识进行分类,其中甲与乙、丙、丁是包含关系.下列各组中,正确的组合是( )
| 选项 | 甲 | 乙、丙、丁 |
| A | 纯净物 | 液氯、KAl(SO4)2、CuSO4•5H2O |
| B | 能导电 | Fe、NaCl晶体、AgCl |
| C | 碱 | 一水合氨、NaOH、纯碱 |
| D | 电解质 | 盐酸、硫酸、硝酸 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. |  与 与  是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| C. | 可用溴水鉴别汽油、四氯化碳和乙酸 | |
| D. | 苯和硝酸反应生成硝基苯与甲烷和氯气反应生成一氯甲烷的反应类型不同 |
9.下列说法不正确的是( )
| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氯化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | Fe、Cu分别与Cl2反应,均生成高价氯化物 |
19.下列说法不正确的是( )
| A. | 硫离子的结构示意图: | |
| B. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 | |
| C. | 氧元素位于第2周期VIA族 | |
| D. | 同周期主族元素随着原子序数的递增,原子半径逐渐减小 |
6.下列属于碱的是( )
| A. | NH3•H2O | B. | MnO2 | C. | HNO3 | D. | NaHCO3 |
3.下列关于物质用途的叙述中不正确的是( )
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 | |
| C. | 明矾溶于水后能产生Al(OH)3胶体,可用作净水剂 | |
| D. | 在医疗上,可用碳酸钠治疗胃酸过多 |
12.下列有关说法正确的是( )
| A. | Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | Na2O2、FeO、Fe2O3均是碱性氧化物 | |
| D. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |