题目内容
11. CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g) 的△H=+247.3 kJ•mol-1.
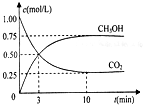
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol 测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min)
②该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$,升高温度,平衡常数的数值将减小(填“增大”、“减小”或“不变”).
③下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是CD.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
④在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76kJ•mol-1
⑤我们常用的一种甲醇燃料电池,是以甲醇与氧气的反应为原理设计的,其电解质溶液是KOH溶液.写出该电池负极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O.
分析 (1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
②CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1 ②
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=$\frac{△c}{△t}$计算v(H2);
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;正反应是放热反应,升高温度,平衡常数的数值将减小;
③使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
④燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,根据燃烧热的概念分析即可解答;
⑤燃料电池中燃料在负极失电子发生氧化反应,碱溶液中生成碳酸钾.
解答 解:(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
②CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1 ②
③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3 kJ•mol-1;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L•mon),
故答案为:0.225;
(2)②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$,正反应是放热反应,升高温度,平衡常数的数值将减小;
故答案为:$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;减小;
(3)使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量,
A、该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B、充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C、将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D、再充入1mol CO2和4mol H2,相当于充入1mol CO2和3mol H2,达平衡后再通入1molH2.等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,再通入1molH2,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
④1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,燃烧热热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;
⑤甲醇-空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,C的化合价有-2价变为+4价,每摩C转移6摩电子,依据电荷守恒和原子守恒,写出电极反应式,电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
点评 本题考查热化学方程式的书写方法、盖斯定律的计算、反应速率计算、化学平衡的计算与影响因素、平衡常数等,难度中等,注意基础知识的掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案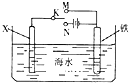
| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
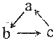 的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | NO | Fe | Al |
| b | CuCl2 | NO2 | FeCl3 | Al(OH)3 |
| c | Cu | HNO3 | FeCl2 | AlO2- |
| A. | A | B. | B | C. | C | D. | D |
| A. | -3 | B. | +1 | C. | +3 | D. | +5 |
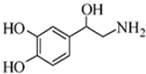
| A. | 该有机物的分子式是C8H10NO3 | |
| B. | 1mol该有机物最多能与2molBr2发生反应 | |
| C. | 该有机物不能与Na2CO3溶液反应 | |
| D. | 该有机物既能与盐酸反应,又能与氢氧化钠溶液反应 |
| A. | 氢硫酸 | B. | 盐酸 | C. | AgNO3溶液 | D. | NaOH溶液 |
| A. | K+,Mg2+,Cl-,OH- | B. | Na+,Cu2+,CO32-,NO3- | ||
| C. | H+,Na+,CO32-,Cl- | D. | Na+,Mg2+,Cl-,SO42- |
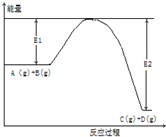 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.