题目内容
1.下列在水溶液中能大量共存的离子组是( )| A. | K+,Mg2+,Cl-,OH- | B. | Na+,Cu2+,CO32-,NO3- | ||
| C. | H+,Na+,CO32-,Cl- | D. | Na+,Mg2+,Cl-,SO42- |
分析 在水溶液中不生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应的离子能大量共存,据此分析解答.
解答 解:A.Mg2+、OH-生成氢氧化镁沉淀而不能大量共存,故A错误;
B.Cu2+、CO32-生成碳酸铜沉淀而不能大量共存,故B错误;
C.H+、CO32-生成二氧化碳和水而不能大量共存,故C错误;
D.这几种离子之间不反应,所以能大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,明确离子共存条件及离子性质是解本题关键,侧重考查复分解反应,注意离子共存时限制性条件,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
12.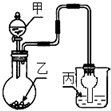 用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
 用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )| 选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
| A | CH3COOH | NaHCO3 | 苯酚钠 | 无明显现象 |
| B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
| C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
| D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
9.某些电解质分子的中心原子最外层不足8电子,其电离时结合其他离子使中心原子最外层达到8电子结构.例如硼酸在水中电离方程式为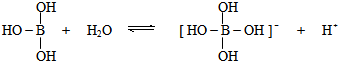 .下列判断正确的是( )
.下列判断正确的是( )
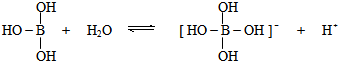 .下列判断正确的是( )
.下列判断正确的是( )| A. | 硼酸是三元酸,抑制水的电离 | |
| B. | 硼酸分子中各原子最外层均达到8电子结构 | |
| C. | 硼酸与NaOH溶液反应的离子方程式:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性氢氧化物,也能与强酸溶液反应 |
3.在一定温度下,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.在a、b中分别加入2mol A和2molB,起始时容器体积均为V L,发生反应2A+B?xC,并达到化学平衡状态,平衡时两容器中A、B、C的物质的量之比均为1:3:6.下列说法一定正确的是( )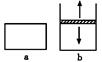

| A. | x的值为2 | |
| B. | B物质可为固体或液体 | |
| C. | 平衡时,a容器的体积小于V L | |
| D. | a、b容器中从起始到平衡所需时间相同 |
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是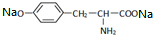 +2H2O.
+2H2O.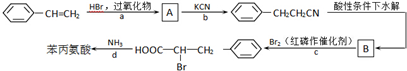
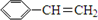 +HBr→
+HBr→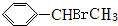 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$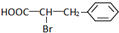 +HBr.
+HBr.