题目内容
17.2molPCl3和1molCl2充入2L定容密闭容器中发生:PCl3(g)+Cl2(g)?PCl5(g),在一定温度下,反应经过2秒钟后刚好反应达平衡,PCl5为0.4mol.请回答下列问题:(1)则此反应在2秒钟内Cl2的平均化学反应速率是:0.1mol/(L•s)
(2)请写出此反应的平衡常数的表达式:$\frac{c(PC{l}_{5})}{c(PC{l}_{3})•c(C{l}_{2})}$
(3)保持恒温,如果对原平衡进行压缩容器的体积,氯气的转化率变化是A
A.增大、B.减小、C.不变
(4)如果对原平衡,此时取走1mol PCl3和0.5molCl2 后,在同条件下反应再次达平衡时,PCl5的物质的量C(选填字母)
A.0.4mol B.0.2mol C.小于0.2mol D.在0.2mol与0.4mol之间
(5)常用饱和食盐水来洗除氯气中少量氯化氢,用平衡移动理论结合有关方程式来简述饱和食盐水的作用:Cl2+H2?H++Cl-+HClO,饱和食盐水中的氯离子使平衡逆向移动,使氯气的溶解度变小.
分析 (1)反应经过2秒钟后刚好反应达平衡,PCl5为0.4mol,根据反应可得2秒钟内Cl2的转化量,再由v$\frac{△c}{△t}$计算反应速率;
(2)根据化学平衡常数为生成物浓度幂之积与反应物浓度幂之积之比列式;
(3)保持恒温,对原平衡进行压缩容器的体积,相当于对原平衡增大压强,平衡正向移动,氯气的转化率增大;
(4)对原平衡,取走1mol PCl3和0.5molCl2 后,减小压强,平衡逆向移动;
(5)饱和食盐水来洗除氯气,有Cl2+H2?H++Cl-+HClO,饱和食盐水中的氯离子使平衡逆向移动,使氯气的溶解度变小.
解答 解:(1)反应经过2秒钟后刚好反应达平衡,PCl5为0.4mol,根据反应可得2秒钟内反应Cl2的物质的量为0.4mol,则此反应在2秒钟内Cl2的平均化学反应速率为$\frac{0.4mol÷2L}{2s}$=0.1 mol/(L•s);
故答案为:0.1 mol/(L•s);
(2)反应,PCl3(g)+Cl2(g)?PCl5(g)则K=$\frac{{C({PC{l_5}})}}{{C({PC{l_3}})C({C{l_2}})}}$;
故答案为:$\frac{c(PC{l}_{5})}{c(PC{l}_{3})•c(C{l}_{2})}$;
(3)保持恒温,对原平衡进行压缩容器的体积,相当于对原平衡增大压强,该反应气体体积减小,增大压强,平衡正向移动,氯气的转化率增大;
故答案为:A;
(4)对原平衡,PCl5为0.4mol,此时取走1mol PCl3和0.5molCl2 后,若平衡不移动,PCl5为0.2mol,但取走物质后相当于减小了压强,平衡逆向移动,PCl5少于0.2mol;
故答案为:C;
(5)饱和食盐水来洗除氯气,有Cl2+H2?H++Cl-+HClO,饱和食盐水中的氯离子使平衡逆向移动,使氯气的溶解度变小;
故答案为:Cl2+H2?H++Cl-+HClO,饱和食盐水中的氯离子使平衡逆向移动,使氯气的溶解度变小.
点评 本题考查反应速率的计算,化学平衡常数,影响化学平衡的因素,题目难度不大,注意基础的掌握,速率的单位容易写漏.

 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | Cl2+H2O?HCl+HClO | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O $\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ |
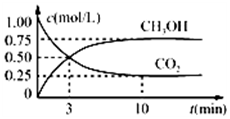 在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3 min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应放热 | |
| C. | 若相同温度下,上述容器容积可变,保持容器内压强不变,同样向容器中充入1 molCO2、3mol H2,则平衡时CO2的浓度与图中相同 | |
| D. | 12 min时,向上述容器中再充入0.25 mol CO2、0.25 mol H2O(g),此时反应将向逆反应方向进行 |

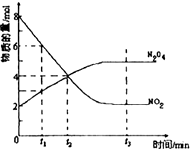 一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器中放入2molN2O4和8molNO2,发生如下反应2NO2(红棕色)═N2O4(无色)△H<0反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答: