题目内容
10.用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )| A. | 不用稀硫酸改用98%的浓硫酸 | B. | 加热 | ||
| C. | 滴加CuSO4溶液 | D. | 不用铁片改用铁粉 |
分析 加快铁与稀硫酸的反应速率,可通过增大浓度、升高温度、形成原电池反应或者增大反应物接触面积等角度,注意铁在常温下与浓硫酸发生钝化现象,阻止了反应的继续进行.
解答 解:A.改用98%的浓硫酸,浓硫酸具有强氧化性,与Fe反应不生成氢气,且发生钝化现象,所以不能加快氢气的生成速率,故A正确;
B.加热,升高温度可加快反应速率,故B错误;
C.滴加少量CuSO4溶液,置换出Cu,形成原电池,发生电化学反应,反应速率加快,故C错误;
D.不用铁片,改用铁粉,增大反应物接触面积,反应速率加快,故D错误;
故选A.
点评 本题考查影响反应速率的因素,题目难度不大,注意温度、浓度、催化剂等条件对反应速率的影响,本题特别是注意原电池反应原理以及固体表面积对反应速率的影响,D为易错点,注意浓硫酸与铁发生钝化,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
4.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1.实验测得起始、平衡时的有关数据如表:
下列叙述正确的是( )
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
1.在1L密闭容器发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ•mol-1(Q>0),容器内部分物质的物质的量浓度如表:
下列说法正确的是( )
| 时间/浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A. | 第4min、第8min时分别达到化学平衡,且平衡常数相同 | |
| B. | 反应在第2min时改变了某一条件,该条件一定是升高温度 | |
| C. | 反应在第2min到第4min时,O2的平均速率为0.1875mol•min-1 | |
| D. | 在开始反应的前2min内,该反应放出0.2QKJ的热量 |
5.某元素最高价氧化物对应水化物的化学式是H3XO4,这种元素的气态氢化物的分子式为( )
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |
2.下列反应不属于取代反应的是( )
| A. | 乙醇在浓硫酸加热140℃条件下反应 | |
| B. | 乙醇与乙酸反应制乙酸乙酯 | |
| C. | 石油裂解制丙烯 | |
| D. | 氯乙烷在氢氧化钠水溶液中加热生成乙醇 |
19.下列实验操作中正确的是( )
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 鉴别己烯和苯:分别向己烯和苯中滴入酸性KMnO4溶液,振荡,观察是否褪色 | |
| C. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| D. | 检验卤代烃中的卤素原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀颜色 |
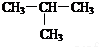

 ,(2)NH3:
,(2)NH3: ,
,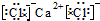 ,(4)CO2:
,(4)CO2: .
.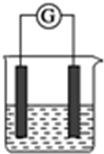 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、Fe、Cu、Zn,组成右图所示的原电池装置(只有两个电极),观察到电流计?的指针均明显转偏,则其可能的组合共有( )