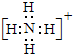题目内容
15.写出下列物质的电子式:(1)N2:
 ,(2)NH3:
,(2)NH3: ,
,(3)CaCl2:
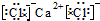 ,(4)CO2:
,(4)CO2: .
.
分析 (1)氮气分子中存在氮氮三键,氮原子最外层为8电子;
(2)NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;
(3)氯化钙为离子化合物,阴阳离子需要标出电荷,氯离子还要标出最外层电子;
(4)CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对.
解答 解:(1)氮气分子中,两个氮原子形成了3对共用电子对,氮气的电子式为: ,
,
故答案为: ;
;
(2)氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ;
;
故答案为: ;
;
(3)氯化钙为离子化合物,电子式中需要标出阴阳离子所带电荷,氯化钙的电子式为: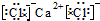 ,
,
故答案为: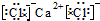 ;
;
(4)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
9.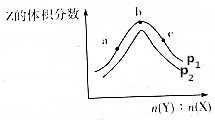 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
3.下列物质中,既有离子键又有共价键的是( )
| A. | MgCl2 | B. | NH4Cl | C. | CO2 | D. | H2S |
10.用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )
| A. | 不用稀硫酸改用98%的浓硫酸 | B. | 加热 | ||
| C. | 滴加CuSO4溶液 | D. | 不用铁片改用铁粉 |
20.有关化学用语正确的是( )
| A. | 乙酸的实验式C2H402 | B. | 聚丙烯的结构简式: | ||
| C. | 羟基的电子式 | D. | 乙酸分子的球棍模型 |
7.下列实验操作或方法正确的是( )
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 利用乙酸乙酯和乙醇的密度不同,可用分液的方法分离 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 用氢氧化钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
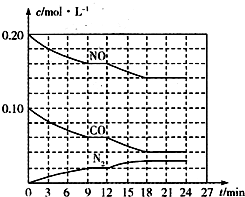 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要. )+c(HSO
)+c(HSO )(用含硫微粒浓度的代数式表示).
)(用含硫微粒浓度的代数式表示).