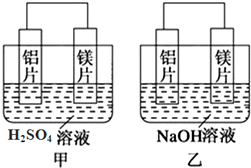
题目内容
11.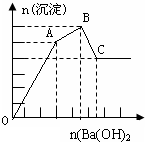 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-═2BaSO4↓+Al(OH)3↓ | |
| B. | C点的沉淀为Fe(OH)3 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+═3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中c(Cl-)>c(SO42-) |
分析 离子方程式为:Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离子,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol.
解答 解:A.假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离了,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;AB段可能发生的反应是Al3++3OH-=Al(OH)3↓,故A错误;
B.分析可知,C点沉淀为BaSO4 和Fe(OH)3,故B错误;
C.OA段可能发生的反应有沉淀钡离子,铁离子,铝离子,反应为,3Ba2++6OH-+3SO42-+Al3++Fe3+→3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,也可能发生3Ba2++6OH-+3SO42-+2Fe3+→3BaSO4↓+2Fe(OH)3↓,故C正确;
D.图象分析FeCl3、Al2(SO4)3的混和溶液中含FeCl3、1mol,含Al2(SO4)31mol,c(Cl-)=c(SO42-),故D错误;
故选C.
点评 本题考查化学反应的有关图象问题、铝化合物性质、混合物的有关计算等,难度较大,关键是清楚各阶段发生的反应,注意从开始到A点相当于是硫酸铝与氢氧化钡的反应生成硫酸钡、氢氧铁沉淀.

| A. | F2+H2O | B. | Cl2+H2O | C. | Na+H2O | D. | Na2O2+H2O |
| 元素 | 有关信息 |
| X | 元素主要化合价-2,原子半径为0.0074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 单质在X的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| D | 最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中的常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)比较Y与Z的氢化物的稳定性HCl>H2S(用化学式表示).
(3)E元素与Y元素可形成EY2和EY3两种化合物,则下列说法中正确的是②③(填序号)
①通常实验室配制EY3溶液时,可直接用水溶解EY3固体
②EY2不能通过单质直接化合产生
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
④Y、Z、D的离子半径大小依次减小
(4)Y的最高价氧化物为无色液体,当0.25mol该物质与一定量的水混合得到一种稀溶液时,放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)写出E在潮湿的空气中发生腐蚀时正极上的电极反应式O2+2H2O+4e-=4OH-.
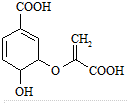
| A. | 分枝酸分子中含有2种官能团 | |
| B. | 分枝酸可与乙醇发生酯化反应 | |
| C. | 分枝酸是芳香族化合物 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| A. | Cu2+,K+,NO3-,I- | B. | AlO2-,Na+,CO32-,K+ | ||
| C. | Ba2+,Fe3+,Cl-,S2- | D. | K+,SiO32-,S2-,Na+ |
①烧焦羽毛味;②蓝色;③银镜(析出银);④砖红色沉淀;⑤黄色;
| 被鉴别的物质 | 鉴别物质(或鉴别方法) | 现象(填入序号即可) |
| 葡萄糖 | 新制氢氧化铜 | ④ |
| 淀粉 | 碘水 | ② |
| 蛋白质 | 浓硝酸 | ⑤ |
| 蛋白质 | 燃烧 | ① |
| 葡萄糖 | 银氨溶液 | ③ |
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 体积:④>①>②>③ | B. | 密度:②>③>①>④ | ||
| C. | 质量:②>③>①>④ | D. | 氢原子数:①>②>③>④ |