题目内容
5.下列反应中水作还原剂的是( )| A. | F2+H2O | B. | Cl2+H2O | C. | Na+H2O | D. | Na2O2+H2O |
分析 水作还原剂,则水中的氧元素化合价升高,以此判断.
解答 解:A、2F2+2H2O=4HF+O2,参加反应的水中氧元素化合价从-2价升高为0价,所以水做还原剂,故A符合;
B、Cl2+H2O═HClO+HCl,参加反应的水中无元素化合价的变化,故B不符合;
C、2Na+2H2O=2NaOH+H2↑,反应前后水中无化合价变化,故C不符合;
D、2Na2O2+2H2O=4NaOH+O2↑反应中水的H、O元素化合价不变,不是氧化剂或还原剂,故D不符合;
故选A.
点评 本题考查了氧化还原反应的特征应用,正确判断元素的化合价是解决本题的关键,题目较简单.

练习册系列答案
相关题目
16.下列有关说法正确的是( )
| A. | 丙烯的结构简式为CH2CHCH3 | |
| B. | 新戊烷的二氯代物有2种 | |
| C. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| D. | 键线式为 的有机物的分子式为C8H10 的有机物的分子式为C8H10 |
13.实验室熔化固体烧碱时应选用的坩埚是( )
| A. | 玻璃坩埚 | B. | 石英坩埚 | C. | 铁坩埚 | D. | 瓷坩埚 |
20.已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X.下列说法中正确的是( )
| A. | 该未知物X为NaI | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为5:2 | |
| C. | 该反应中,发生氧化反应的过程是KIO3→I2 | |
| D. | 由反应可知还原性强弱顺序为:Na2SO3>I2 |
14.下列化工生产过程中,未涉及氧化还原反应的是( )
| A. | 海带提碘 | B. | 氯碱工业 | ||
| C. | 煅烧石灰石制取生石灰 | D. | 海水提溴 |
11.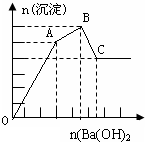 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-═2BaSO4↓+Al(OH)3↓ | |
| B. | C点的沉淀为Fe(OH)3 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+═3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中c(Cl-)>c(SO42-) |
 如图,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题:
如图,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.试回答下列问题: 请按要求回答下列问题.
请按要求回答下列问题.