题目内容
10.硫单质及其化合物在工农业生产中有着极其重要的应用.(1)1molSO2与氯酸钠在酸性条件下反应生成消毒杀菌剂ClO2,该反应的氧化产物为Na2SO4,转移电子2mol.
(2)羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)=H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)=H2S(g)+CO2△H2
已知反应中相关的化学键键能数据如表:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A.溶液A在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑.
(4)经检测,某溶液中除SO42-外还有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
①a的值为0.15.
②当通入Cl2的体积为3.36L(标准状况下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.5mol/L.
分析 (1)根据1molSO2与氯酸钠在酸性条件下反应生成ClO2,说明氯酸钠作氧化剂将SO2氧化成硫酸钠,自身被还原成ClO2,据此分析计算;
(2)水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变等于旧键断裂吸收的能量和新键生成释放能量的差;
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A为Na2S,Na2S溶液在空气中长期放置发生反应,生成物之一为B,B与过氧化钠的结构和化学性质相似,则B为Na2S2,据此分析解答;
(4)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,先后发生:Cl2+2I-═I2+2Cl-,Cl2 +2Br-═Br2+2Cl-,根据反应方程式计算.
解答 解:(1)由1molSO2与氯酸钠在酸性条件下反应生成ClO2,说明氯酸钠作氧化剂将SO2氧化成硫酸钠,自身被还原成ClO2,所以氧化产物为Na2SO4,转移电子1mol×(6-4)=2mol.故答案为:Na2SO4;2;
(2)由焓变等于旧键断裂吸收的能量和新键生成释放能量的差得,COS(g)+H2O(g)═H2S(g)+CO2(g)△H2=(742+465×2)-(339+803)=-35kJ/mol,故答案为:-35;
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A为Na2S,Na2S溶液在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,则B为Na2S2,所以B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑,故答案为:Na2S2+H2SO4=Na2SO4+S↓+H2S↑;
(4)①2.8L氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,溶液中氯离子为通入氯气生成的和原来溶液中存在的,Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,根据反应:Cl2+2I-═I2+2Cl-,该反应中生成0.25mol氯离子消耗碘离子,所以a=0.5mol-0.25mol=0.15mol,故答案为:0.15;
②通过以上分析知,当通入Cl2的体积为3.36L即0.15mol(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;n(Cl-)=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,溶液体积相同,c(Br-)=$\frac{1.5mol}{2L}$=0.75mol/L,c(I-)=$\frac{1mol}{2L}$=0.5mol/L,
故答案为:Cl2+2I-=2Cl-+I2;0.75mol/L;0.5mol/L.
点评 本题主要考查了氧化还原反应的计算、盖斯定律、物质推断以及离子的判断和有关计算,难点为(4),准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.

| A. | 棉花 | B. | 光导纤维 | C. | 羊毛 | D. | 蚕丝 |
| A. | 烧碱 | B. | 玻璃 | C. | 石灰石 | D. | 胆矾 |
| A. | 除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性 | |
| C. | 在相同浓度的盐酸中,纯铁比含碳量较高的生铁反应速率快 | |
| D. | 冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属 |
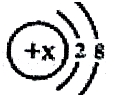 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.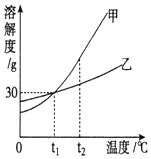 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.