题目内容
15.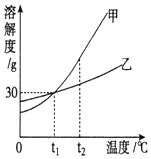 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.(1)t1℃时,甲、乙两种物质的溶解度相等.
(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:甲<乙(填“>”、“<”或“=”).
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是B(填序号,下同).
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
(4)除去甲物质中少量乙物质可采取降温结晶的方法.
分析 (1)溶解度曲线的交点表示该温度下物质的溶解度相等;
(2)据t2℃时甲乙的溶解度大小分析解答;
(3)据甲的溶解度随温度变化情况及不饱和溶液、饱和溶液的转化方法分析解答;
(4)据甲、乙的溶解度随温度变化情况分析分离物质的方法.
解答 解:(1)溶解度曲线的交点表示该温度下物质的溶解度相等,t1℃时甲、乙两种物质的溶解度相等,
故答案为:t1;
(2)t2℃时甲的溶解度大于乙的溶解度相等,所以将等质量的甲、乙两种物质加水溶解配制成饱和溶液,需要水的质量甲小于乙,故所得溶液的质量是甲小于乙,故答案为:<;
(3)甲的溶解度随温度升高而增大,不饱和溶液变为饱和溶液的方法有增加溶质、蒸发溶剂、降低温度的方法;
A、若采取增加溶质、降温的方法,则溶剂的质量不变,故A错误;
B、若采取降温恰好饱和的方法,溶质的质量不变,采取增加溶质的方法,溶质质量增加,故溶质的质量可能不变,故B正确;
C、若采取降温恰好饱和的方法,则溶质的质量分数不变,故C错误;
D、若采取降温恰好饱和的方法,则溶液的质量不变,故D错误,
故答案为:B;
(4)甲的溶解度随温度的升高而增大,乙的溶解度受温度影响不大,故除去甲物质中少量乙物质可采取蒸发浓缩,降温结晶的方法,
故答案为:降温.
点评 本题考查了溶解度曲线的应用,及不饱和溶液和饱和溶液的相互转化,考查了学生分析解决问题的能力,题目难度中等.

练习册系列答案
相关题目
15.下列化学方程式不正确的是( )
| A. | CH3CO18OC2H5+H2O $?_{△}^{稀硫酸}$ CH3COOH和C2H518OH | |
| B. | 溴乙烷与氢氧化溶液共热:CH3CH2Br+NaOH $→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 蔗糖水解: +H2O$\stackrel{催化剂}{→}$ +H2O$\stackrel{催化剂}{→}$ | |
| D. | 苯酚钠中通入二氧化碳: +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 |
3.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
| A. | Zn为电池的正极 | |
| B. | 负极反应式为2FeO42-+10H++6e-═Fe2O3+5H2O | |
| C. | 该电池使用完不可随便丢弃,应深埋地下 | |
| D. | 电池工作时OH-向负极迁移 |
10.硫单质及其化合物在工农业生产中有着极其重要的应用.
(1)1molSO2与氯酸钠在酸性条件下反应生成消毒杀菌剂ClO2,该反应的氧化产物为Na2SO4,转移电子2mol.
(2)羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)=H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)=H2S(g)+CO2△H2
已知反应中相关的化学键键能数据如表:
则△H2=-35kJ/mol.
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A.溶液A在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑.
(4)经检测,某溶液中除SO42-外还有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示.
分析后回答下列问题:
①a的值为0.15.
②当通入Cl2的体积为3.36L(标准状况下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.5mol/L.
(1)1molSO2与氯酸钠在酸性条件下反应生成消毒杀菌剂ClO2,该反应的氧化产物为Na2SO4,转移电子2mol.
(2)羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)=H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)=H2S(g)+CO2△H2
已知反应中相关的化学键键能数据如表:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A.溶液A在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑.
(4)经检测,某溶液中除SO42-外还有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
①a的值为0.15.
②当通入Cl2的体积为3.36L(标准状况下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.5mol/L.
7.下列说法正确的是( )
| A. | 不粘锅的原料 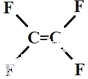 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 聚乙烯塑料袋因有毒,不可以装食品 |
4.在一定温度下,向足量的饱和碳酸钠溶液中加入5.3g无水碳酸钠,搅拌静置后,最终所得晶体的质量有可能是( )
| A. | 5.3g | B. | 10.6g | C. | 14.3g | D. | 16.4g |
5. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3 kJ/(g.℃),则该反应的中和热为△H=-56.5kJ/mol(保留小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
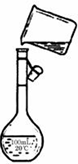 (5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流
(5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流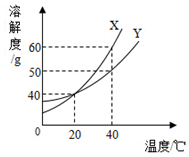 X、Y两种固体的溶解度曲线见图.
X、Y两种固体的溶解度曲线见图.