题目内容
5.下列物质中,主要成分属于硅酸盐的是( )| A. | 烧碱 | B. | 玻璃 | C. | 石灰石 | D. | 胆矾 |
分析 在无机非金属材料中,硅及其化合物是密切联系生产生活的一类重要物质,陶瓷、玻璃、水泥等都是硅酸盐产品.
解答 解:A.烧碱是氢氧化钠,不属于硅酸盐,故A错误;
B.玻璃是二氧化硅、纯碱和石灰石高温反应生成的,玻璃成分为硅酸盐,故B正确;
C.石灰石的成分是碳酸钙,不属于硅酸盐,故C错误;
D.胆矾是硫酸铜晶体,不是硅酸盐,故D错误.
故选B.
点评 本题考查硅酸盐产品,难度较小,明确物质的组成是解答本题的关键,注意基础知识的积累掌握,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | C2H6和C5H12一定互为同系物 | |
| B. | 1mol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | 三氯甲烷只有一种结构证明甲烷是正四面体构型 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
13.初中化学反应的基本类型包括:化合反应、分解反应、置换反应和复分解反应.下列反应中不属于这四种基本类型的是( )
| A. | CO2+H2O═H2CO3 | B. | CO+CuO═Cu+CO2 | ||
| C. | 2H2O═2H2↑+O2↑ | D. | FeS+H2SO4═FeSO4+H2S↑ |
20.现有下列六个转化,其中不能通过一步反应实现的是( )
①SiO2→Na2SiO3 ②S→SO3 ③NH3→N2
④CuO→Cu(OH)2 ⑤Cl2→NaClO ⑥SO2→H2SO4.
①SiO2→Na2SiO3 ②S→SO3 ③NH3→N2
④CuO→Cu(OH)2 ⑤Cl2→NaClO ⑥SO2→H2SO4.
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ②④ |
10.硫单质及其化合物在工农业生产中有着极其重要的应用.
(1)1molSO2与氯酸钠在酸性条件下反应生成消毒杀菌剂ClO2,该反应的氧化产物为Na2SO4,转移电子2mol.
(2)羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)=H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)=H2S(g)+CO2△H2
已知反应中相关的化学键键能数据如表:
则△H2=-35kJ/mol.
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A.溶液A在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑.
(4)经检测,某溶液中除SO42-外还有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示.
分析后回答下列问题:
①a的值为0.15.
②当通入Cl2的体积为3.36L(标准状况下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.5mol/L.
(1)1molSO2与氯酸钠在酸性条件下反应生成消毒杀菌剂ClO2,该反应的氧化产物为Na2SO4,转移电子2mol.
(2)羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染.羰基硫的氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)=H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)=H2S(g)+CO2△H2
已知反应中相关的化学键键能数据如表:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A.溶液A在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑.
(4)经检测,某溶液中除SO42-外还有大量的Cl-、Br-、I-,若向2L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示.
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
①a的值为0.15.
②当通入Cl2的体积为3.36L(标准状况下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2.
此时溶液中Br-、I-的物质的量浓度分别为c(Br-)=0.75mol/L,c(I-)=0.5mol/L.
17.已知25℃时,下列酸的电离常数:
则物质的量浓度均为0.1mol•L-1的上述溶液c(H+)最大的是( )
| 物质名称 | 醋酸 | 氢氰酸 | 氢氟酸 | 甲酸 |
| 电离常数K | 1.75×10-5 | 4.93×10-10 | 7.2×10-4 | 1.77×10-4 |
| A. | 醋酸 | B. | 氢氰酸 | C. | 氢氟酸 | D. | 甲酸 |


 +H3C
+H3C $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +CH3COOH
+CH3COOH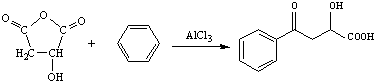 .
.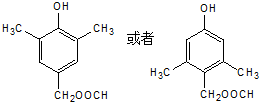 .
. 、
、 其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论: