题目内容
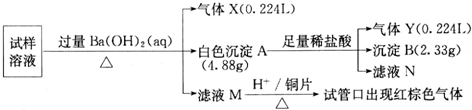
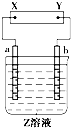 图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )
图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,电解一段时间后,再加入相应的物质,溶液能与原来溶液完全一样.符合这一情况的是下表中的( )| a电极 | b电极 | X电极 | 溶液 | 所加物质 | |
| A | 锌 | 石墨 | 负极 | CuSO4 | CuO |
| B | 石墨 | 石墨 | 负极 | NaOH | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 | CuO |
| A、A | B、B | C、C | D、D |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:a极板质量增加,应在a极上析出金属,则a为电解池的阴极,X应为电源的负极,则b极应为电解池的阳极,Y为电源的正极,b板有无色无味的气体放出,应发生氧化反应,生成气体为氧气,加入相应的氧化物,可以使溶液能与原来溶液完全一样,以此解答该题.
解答:
解:a极板质量增加,应在a极上析出金属,则a为电解池的阴极,X应为电源的负极,则b极应为电解池的阳极,Y为电源的正极,加入相应的氧化物,可以使溶液能与原来溶液完全一样,
A、b极为石墨,氢氧根离子被氧化产生氧气,a极铜离子放电产生铜,电解后加入CuO能够恢复,故A正确;
B、由以上分析可知,X为电源的负极,电解NaOH溶液,阳极生成氧气,无色无味,阴极生成氢气,反应后应加入水,故B错误;
C、Fe做阳极,放电生成亚铁离子,不会产生气体,故C错误;
D.电解质为CuCl2溶液,在阳极生成黄绿色有刺激性的Cl2,故D错误.
故选A.
A、b极为石墨,氢氧根离子被氧化产生氧气,a极铜离子放电产生铜,电解后加入CuO能够恢复,故A正确;
B、由以上分析可知,X为电源的负极,电解NaOH溶液,阳极生成氧气,无色无味,阴极生成氢气,反应后应加入水,故B错误;
C、Fe做阳极,放电生成亚铁离子,不会产生气体,故C错误;
D.电解质为CuCl2溶液,在阳极生成黄绿色有刺激性的Cl2,故D错误.
故选A.
点评:本题考查电解原理,题目难度中等,本题注意根据两极的变化正确判断电源的正负极为解答该题的关键,注意把握电解原理.

练习册系列答案
相关题目
在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)?C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
| A、在5 min 内该反应用C的浓度变化表示的反应速率为0.02 mol/(L?min) |
| B、5 min 时,容器内D的浓度为0.2 mol/L |
| C、该可逆反应随反应的进行,容器内压强逐渐增大 |
| D、5 min时容器内气体总的物质的量为3 mol |
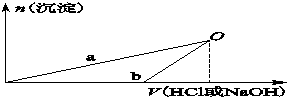 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案①:2.7g Al
| 100ml稀盐酸 |
| NaOH溶液 |
方案②:2.7g Al
| 100mlNaOH溶液 |
| 稀盐酸 |
NaOH溶液和稀盐酸的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
参照反应Br2+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是( )
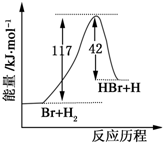

| A、反应物具有的总能量大于生成物具有的总能量 |
| B、正反应为吸热反应 |
| C、逆反应为吸热反应 |
| D、从图中可看出,该反应的反应热与反应途径有关 |