��Ŀ����
9��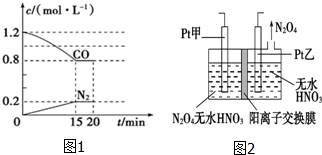 �������ǵ������绷���ȵ㻰�⣮Ŀǰ�ҹ�����ط�����������ԭ��֮һ�ǻ�����β����ȼú������������NO��CO�����Ϊ����β���ijɷ֣������������ڴ�ת�����з������·�Ӧ��
�������ǵ������绷���ȵ㻰�⣮Ŀǰ�ҹ�����ط�����������ԭ��֮һ�ǻ�����β����ȼú������������NO��CO�����Ϊ����β���ijɷ֣������������ڴ�ת�����з������·�Ӧ��2NO��g��+2CO��g��$\stackrel{����}{?}$2CO2��g��+N2��g����H=-akJ•mol-1��a��0��
��1����һ���¶��£���2.0mol NO��2.4mol CO����ͨ�뵽�̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ�Ũ�ȱ仯��ͼ1��ʾ��
��0��15min N2��ƽ������v��N2��=0.013mol/��L•min����NO��ת����Ϊ40%��
��20minʱ�����ı䷴Ӧ����������COŨ�ȼ�С����ı������������cd��ѡ����ţ���
a�����������
b������CO����
c�������¶�
d�������������
�������ַ�Ӧ��ϵ���¶Ȳ��䣬20minʱ���������г���NO��N2��0.4mol����ѧƽ�⽫�����ƶ���ѡ����������ҡ������������´ﵽƽ��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ$\frac{5}{36}$L/mol��
��2����֪��2NO��g��+O2��g���T2NO2��g����H=-b kJ•mol-1��b��0��CO��ȼ���ȡ�H=-c kJ•mol-1��c��0��������������β����NO2����Ⱦʱ��NO2��CO������Ӧ���Ȼ�ѧ��Ӧ����ʽΪ4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a+b-2c�� kJ•mol-1��
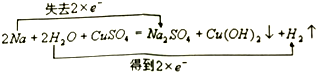
��3����ҵ�����к��е�NO2�����õ�ⷨ�������Ʊ�����֮һ���Ƚ�NO2ת��ΪN2O4��Ȼ����õ�ⷨ�Ʊ�N2O5��װ����ͼ2��ʾ��Pt��Ϊ����������������N2O5�ĵ缫��Ӧʽ��N2O4+2HNO3-2e-�T2N2O5+2H+��
���� ��1���ٸ���v=$\frac{��c}{��t}$��ת����=$\frac{������}{��ʼ��}$��100%���м��㣻
�����ı䷴Ӧ����������COŨ�ȼ�С�����Բ��øı��¶Ȼ������ݻ��ķ�����
�۸���ƽ��ʱŨ�ȣ����ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������ƽ�ⳣ�����ٸ���Ũ�����뻯ѧƽ�ⳣ����Դ�С�ж�ƽ���ƶ�����
��2����֪��2NO��g��+2CO��g��$\stackrel{����}{?}$2CO2��g��+N2��g����H=-a kJ•mol-1��
2NO��g��+O2��g���T2NO2��g����H=-b kJ•mol-1��b��0����
CO��ȼ���ȡ�H=-c kJ•mol-1��c��0����
������������β����NO2����Ⱦʱ�����ݸ�˹���ɢ�-��-2���۵õ������Ȼ�ѧ����ʽ��
��3��Pt�Ҽ�����ˮ����õ�N2O4��������ԭ��Ӧ������Pt��Ϊ������N2O4��������N2O5�����ݵ���غ��ԭ���غ���ƽ��д�缫��Ӧ��
��� �⣺��1����0��15min��C��N2��=0.2mol/L����0��15min N2��ƽ������v��N2��=$\frac{0.2mol/L}{15min}$��0.013mol/��L•min����
��C��N2��=0.2mol/L�����C��NO��=2��C��N2��=0.2��2=0.4mol/L����n��NO��=0.4mol/L��2L=0.8mol����NO��ת����=$\frac{0.8}{2}$��100%=40%��
�ʴ�Ϊ��0.013mol/��L•min����40%��
��a����С���������ѹǿ����ƽ��������Ӧ�����ƶ�����COŨ������a����
b������CO������ƽ��������Ӧ�����ƶ�����CO��Ũ������a����
c�������¶ȣ�ƽ��������Ӧ�����ƶ�����CO��Ũ�ȼ�С����c��ȷ��
d���������������ѹǿ��С��ƽ�����淴Ӧ�����ƶ�����COŨ�ȼ�С����d��ȷ��
�ʴ�Ϊ��cd��
�۵�һ��ƽ��ʱc��N2��=0.2mol/L��c��CO��=0.8mol/L��c��CO2��=2c��N2��=0.4mol/L��c��NO��=$\frac{2.0mol}{2}$=0.6mol/L��
��ѧƽ�ⳣ��K=$\frac{[C{O}_{2}]^{2}[{N}_{2}]}{[NO]^{2}[CO]^{2}}$=$\frac{0��{4}^{2}��0.2}{0��{6}^{2}��0��{8}^{2}}$=$\frac{5}{36}$L/mol��
�����ַ�Ӧ��ϵ���¶Ȳ��䣬20minʱ���������г���NO��N2��0.4mol����c��CO��=0.8mol/L��c��CO2��=0.4mol/L��c��N2��=0.2mol/L+$\frac{0.4}{2}$mol/L=0.4mol/L��c��NO��=0.6mol/L+$\frac{0.4}{2}$mol/L=0.8mol/L����Ũ����Qc=$\frac{0��{4}^{2}��0.4}{0��{8}^{2}��0��{8}^{2}}$=$\frac{5}{32}$L/mol��$\frac{5}{36}$L/mol����ƽ�������ƶ����¶Ȳ��䣬��ѧƽ�ⳣ�����䣬
�ʴ�Ϊ������$\frac{5}{36}$L/mol��
��2����֪��2NO��g��+2CO��g��$\stackrel{����}{?}$2CO2��g��+N2��g����H=-a kJ•mol-1��
2NO��g��+O2��g���T2NO2��g����H=-b kJ•mol-1��b��0����
CO��ȼ���ȡ�H=-c kJ•mol-1��c��0����
������������β����NO2����Ⱦʱ��NO2��CO������Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��
���ݸ�˹���ɢ�-��-2���۵ã�4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a+b-2c�� kJ•mol-1 ��
�ʴ�Ϊ��4CO��g��+2NO2��g��=N2��g��+4CO2��g����H=��-a+b-2c�� kJ•mol-1��
��3��Pt�Ҽ�����ˮ����õ�N2O4��������ԭ��Ӧ������Pt��Ϊ������N2O4��������N2O5���Ե���������N2O5�ĵ缫��Ӧʽ�ǣ�N2O4+2HNO3-2e-�T2N2O5+2H+��
�ʴ�Ϊ������N2O4+2HNO3-2e-�T2N2O5+2H+��
���� ���⿼�黯ѧ��Ӧ���ʵļ��㡢��ѧƽ���ƶ�ԭ������ѧƽ�ⳣ���ļ��㣬ԭ���ԭ��������Ӧ�ã��ѶȽϴ�Ҫע�����û�ѧƽ�ⳣ����Ũ���̵Ĺ�ϵȷ����Ӧ����

| A�� | �����Ȼ�̼��ȡ | B�� | ������������Һϴ�� | ||
| C�� | �õ⻯����Һϴ�� | D�� | ��������������Һϴ�� |
| ��ѧ��Ӧ | �ʱ� | ƽ�ⳣ�� | �¶�/�� | ||
| 500 | 700 | 800 | |||
| ��2H2��g��+CO��g��?CH3OH��g�� | ��H1 | K1 | 2.5 | 0.34 | 0.15 |
| ��CO2��g��+H2��g��?CO��g��+H2��g�� | ��H2 | K2 | 1.0 | 1.70 | 2.52 |
| ��CO2��g��+3H2��g��?CH3OH��g��+H2��g�� | ��H3 | K3 | |||
��1����Ӧ�������ȣ�����ȡ����ȡ�����Ӧ��
��2���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=K1��K2����K1��K2��ʾ����
��3��Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��BC������ĸ��ţ���
A����С��Ӧ�������ݻ� B������Ӧ�������ݻ�
C�������¶� D��ʹ�ú��ʵĴ���
E����ƽ����ϵ�м�ʱ�����CH3OH
��4��500��ʱ����÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�mol•L-1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv����v�棨���������=����������
��5���״�����Ҫ�Ļ�������ԭ�ϣ�����һ�����͵�ȼ�ϣ��������������һ��ȼ�ϵ�أ�һ���缫ͨ���������һ���缫����״�����صĵ�����Dz�����Y2O3��ZrO2���壬�����ڸ������ܴ���O2-���ӣ��õ�ص�������ӦʽΪO2+4e-=2O2-����ع���ʱ�������������O2-���ƶ���
��6��300��ʱ����һ����ѹǿ�£�5molCO��������H2�ڴ�����������ǡ����ȫ��Ӧ�仯������Ϊ454kJ���ڸ��¶�ʱ�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| ƽ��ʱ���� | CH3OH��Ũ�ȣ�mol/L�� | C1 | C2 | C3 |
| ��Ӧ��ϵ�������仯 | aKJ | bKJ | cKJ | |
| ��ϵѹǿ��Pa�� | P1 | P2 | P3 | |
| ��Ӧ��ת���� | a1 | a2 | a3 | |
A��2c1��c3 B��a+b��90.8 C��2p2��p3 D����1+��3��1��
| A�� | Mg3N2+6H2O�T3Mg��OH��2��+2NH3�� | B�� | 2Na+2H2O�T2NaOH+H2�� | ||
| C�� | 2NO2+H2O�T2HNO3+NO | D�� | 2F2+2H2O�T4HF+O2 |
| A�� | NH3��O2 | B�� | NH3��Cl2 | C�� | NH3��H2 | D�� | NH3��CO2 |
 ��
��
 Ŀǰ��ҵ�ϳɰ���ԭ����N2��g��+3H2��g��?2NH3��g����H=-93.0kJ•mol-1
Ŀǰ��ҵ�ϳɰ���ԭ����N2��g��+3H2��g��?2NH3��g����H=-93.0kJ•mol-1