题目内容
7.氨气是化学工业上应用非常广泛的物质.侯氏制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳.现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全.试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水).| 1 | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(2)a mol NO完全转化为HNO3理论上需要氧气0.75amol;为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为0.14.
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为HNO3的转化率.
(写出简要计算过程)
分析 (1)根据反应的方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O计算生成Na2CO3的质量;根据溶解度计算出需要的水的质量,减去反应的水的质量,最终计算出剩余水的质量;根据反应的方程式计算生成NaHCO3的质量,结合溶解度计算析出晶体的质量;根据水的质量,结合各物质的溶解度判断析出晶体并计算质量;
(2)根据一氧化氮和氧气完全转化为HNO3的关系式计算;使NH3恰好完全氧化为NO,根据氨气计算需要氧气的量,再根据体积分数公式进行计算;
(3)根据反应过程中氮气的量不变进行计算,算出生成硝酸的物质的量,再根据原子守恒计算转化率.
解答 解:(1)117g食盐的物质的量为n(NaCl)=$\frac{117g}{58.5g/mol}$=2mol,
则 NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
1 1 1
2mol 2mol 2mol
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2 1
2mol 1mol
n(Na2CO3)=1mol,m(Na2CO3)=1mol×106g/mol=106g,
取117g食盐配制成饱和溶液,需要水的质量为:$\frac{117g×100}{37.0}$=316g,用掉水的质量为2mol×18g/mol=36g,溶液中剩余水的质量为:316g-36g=280g,
m(NaHCO3)=2mol×84g/mol=168g,此时,溶液中水的质量为280g,溶解NaHCO3的质量为$\frac{280}{100}$×14g≈39.0g,所以析出的质量为168g-39g=129g,
水的质量为280g,则过滤除去晶体后再降温至10℃,溶解NaHCO3的质量为8.15g×$\frac{280}{100}$=22.8g,析出NaHCO3的质量为39.0-22.8=16.2g,
生成的NH4Cl质量为2mol×53.5g/mol=107g,溶液溶解的NH4Cl质量为33.0g×$\frac{280}{100}$=92.4g,析出的NH4Cl质量为107g-92.4g=14.6g,
所以析出的物质的为NH4Cl和NaHCO3,总质量为16.2g+14.6g=30.8g,
故答案为:106;280;129;30.8;
(2)设需要氧气的物质的量为x,
4NO+2H2O+3O2=4HNO3
4mol 3mol
amol x
x=$\frac{3a}{4}$mol=0.75amol,则需要氧气的物质的量为0.75a mol,
根据氨气被氧气恰好完全氧化为NO的方程式,可假设氨气的体积是4L,设需要空气的体积为y,
4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O
4 5
4L 0.20y
y=$\frac{4×5}{4×0.20}$L=25L,氨-空气混合物中氨的体积分数=$\frac{4L}{4L+25L}$≈0.14,
故答案为:0.75a;0.14;
(3)设生成x mol HNO3,空气中氧气的体积分数为0.20,氮气的体积分数为0.80,空气中氮气的量是氧气的4倍,4(2x+18.0×$\frac{5}{4}$+12.0)=150.0,解得:x=1.5(mol),根据氮原子守恒,NH3的转化为HNO3的转化率=$\frac{1.5mol}{20.0mol}$×100%=7.5%,
故答案为:7.5%.
点评 本题考查纯碱的制备和计算、氧化还原反应的计算,难点是计算转化率,明确氮气和氧气的关系是解答关键,题目难度中等,注意有关溶解度计算的方法.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | XY | B. | X3Y | C. | XY3 | D. | X2Y3 |
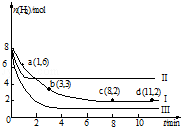 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
| A. | 简单气态氢化物沸点Y>X>W | |
| B. | 原子半径Z>Y>X>W | |
| C. | Y元素可能位于第二周期第ⅦA族 | |
| D. | Y元素与其它三种元素均可形成多种化合物 |
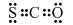 ;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
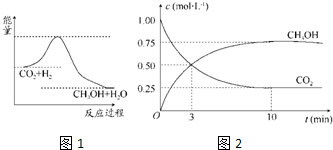
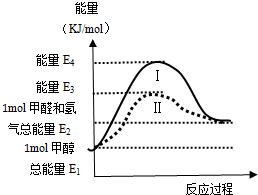 甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.
甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.