��Ŀ����
2��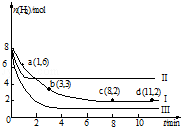 һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������
һ���¶��£����ݻ�Ϊ2L�ĺ����ܱ������г���6mol CO2��8mol H2��������Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1�����n��H2����ʱ��仯�����ߢ���ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ��0��8 min��CO2��ƽ����Ӧ������ 0.375 mol•L-1•min-1 | |
| B�� | ����ʼʱ�����������г���3 mol CO2��4 mol H2����ƽ��ʱH2�������������20% | |
| C�� | ����ʼʱ�����������г���4 mol CO2��2 mol H2��2 mol CH3OH��1mol H2O��g�������ʱ��Ӧ������Ӧ������� | |
| D�� | �ı������õ����ߢ������ߢ�ı�������ֱ��������¶ȡ����뺤�� |
���� A������v=$\frac{��c}{��t}$����v��H2��������������֮�ȵ����仯ѧ������֮�ȼ���v��CO2����
B����ͼ��֪��Iƽ��ʱ����Ϊ2mol����������ʽ����ƽ��ʱ��������ʵ������������������������������ʼʱ�����������г���3 mol CO2��4 mol H2����ЧΪԭƽ��ѹǿ��Сһ����ƽ�����淴Ӧ�����ƶ��������������������
C������B�м����֪ƽ��ʱ������̼���������״���ˮ��Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$����ƽ�ⳣ�����ټ����ʱ��Ũ����Qc����ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���з���
D�������ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ�ȴ�˵���ı�������Ӧ���ʼӿ졢��Ӧ���淴Ӧ�����ƶ�����I��ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ��С��˵���ı�������Ӧ���ʼӿ졢��Ӧ������Ӧ�����ƶ���
��� �⣺A����ͼ��֪��0��8 min��H2�����ʵ����仯��Ϊ8mol-2mol=6mol����v��H2��=$\frac{\frac{6mol}{2L}}{8min}$=0.375 mol•L-1•min-1������֮�ȵ����仯ѧ������֮�ȣ���v��CO2��=$\frac{1}{3}$v��H2��=0.125 mol•L-1•min-1����A����
B����ͼ��֪��Iƽ��ʱ����Ϊ2mol����
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol����6 8 0 0
ת����mol����2 6 2 2
ƽ�⣨mol����4 2 2 2
��I��ƽ��ʱ�����������Ϊ��$\frac{2mol}{4mol+2mol+2mol+2mol}$=20%������ʼʱ�����������г���3 mol CO2��4 mol H2����ЧΪԭƽ��ѹǿ��Сһ����ƽ�����淴Ӧ�����ƶ��������������������ƽ��ʱH2�������������20%����B��ȷ��
C��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��•c��{H}_{2}O��}{c��C{O}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{1��1}{2��{1}^{3}}$=0.5����ʱ��Ũ����Qc=$\frac{\frac{2}{2}��\frac{1}{2}}{\frac{4}{2}����\frac{2}{2}��^{3}}$=0.25��K=0.5����ƽ��������Ӧ�����ƶ�����C��ȷ��
D�������ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ�ȴ�˵���ı�������Ӧ���ʼӿ졢��Ӧ���淴Ӧ�����ƶ����������¶ȣ���Ӧ���ʼӿ죬����ӦΪ���ȷ�Ӧ��ƽ�����淴Ӧ�����ƶ����������⣻��I��ȣ���ƽ��ʱ��̣���ƽ��ʱ����Ũ��С��˵���ı�������Ӧ���ʼӿ졢��Ӧ������Ӧ�����ƶ��������뺤������Ӧ��������ֵ�Ũ�Ȳ��䣬��Ӧ���ʲ��䡢ƽ�ⲻ�ƶ������������⣬��D����
��ѡBC��
���� ���⿼�黯ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��漰���ʵ�����ʱ��仯���ߡ���Ӧ����Ӱ�����ؼ����㡢��ѧƽ��Ӱ����������㡢ƽ�ⳣ��Ӧ�õ�֪ʶ�����ؿ���ѧ����������������C��ע������ƽ�ⳣ���жϷ�Ӧ���з�������������ѧ���ķ�����������������ѧ����������

| A�� | ��������Һ�ı��������Ƿ�ɢ�ʿ����Ĵ�С��ͬ | |
| B�� | �Ȼ�����Һ��Ӧ��ֹѪ�����õ��ǽ���ľ۳� | |
| C�� | ��Һ�ǵ����Եģ������Ǵ���� | |
| D�� | ��ϡ������μ����������������У���ʼʱ���������������μ�ʱ�������ܽ� |
| A�� | HCl��CO2��CO | B�� | CO��H2��H2O | C�� | HCl��CO2��H2 | D�� | HCl��CO2��H2 |
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g��+2H2��g��??CH3OH��g����H1
��Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����I�������
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£���1mol CO��3mol H2����1L���ܱ������У���ַ�Ӧ���ﵽƽ���
���c��CO��=0.2mol•L-1����CO��ת����Ϊ80%����ʱ���¶�Ϊ250�棨���ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1 275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ•mol-1
��H2O��g���TH2O��l����H3=-44.0kJ•mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=-442.8kJ•mol-1��
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10�� | 35.8 | 8.15 | 33.0 |
| 45�� | 37.0 | 14.0 | 50.0 |
��ҵ������Ҳ�ǰ�����Ҫ��;֮һ����Ӧ���£�
4NH3+5O2��4NO+6H2O 2NO+O2��2NO2 3NO2+H2O��2HNO3+NO
��������������������Ϊ0.20���������������Ϊ0.80��
��2��a mol NO��ȫת��ΪHNO3��������Ҫ����0.75amol��ΪʹNH3ǡ����ȫ����ΪNO����-������������а��������������С����ʾ��Ϊ0.14��
��3��20.0mol NH3�ÿ����������������������Ϊ��NO 18.0mol��O2 12.0mol��N2 150.0mol��һ�������ᣬ�Լ������ɷ֣�������NO��O2�����ϣ������㰱ת��ΪHNO3��ת���ʣ�
��д����Ҫ������̣�
��֪����ӦI��4NH3��g��+6NO��g��?5N2��g��+6H2O��l����H1
��ӦII��2NO��g��+O2��g��?2NO2��g����H2 ����|��H1|=2|��H2|��
| �¶�/K | ��ӦI | ��ӦII | ��֪�� K2��K1��K2�䣾K1�� |
| 298 | K1 | K2 | |
| 398 | K1�� | K2�� |
������˵������ȷ����C
A����ӦI����λʱ����H-O����N-H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
B����ӦI�����ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ��
C����ӦII������ѹǿ��ʹ��Ӧ���ʼӿ죬����Ϊ�����˻���Ӱٷ���
D�����º��������£���ӦII�ﵽƽ��ʱ��ϵ��n��NO����n��O2����n��NO2��=2��1��2����������������ʱ���ٳ���NO2����ﵽƽ�⣬NO2����������

 ���ྻú�������о����������൱�ձ飮
���ྻú�������о����������൱�ձ飮