题目内容
16.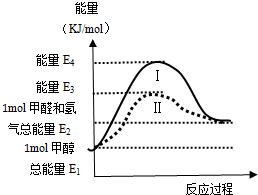 甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.
甲醇是重要的化工原料,气态甲醇催化脱氢制备甲醛转化的能量关系如图所示.(1)甲醇脱氢转化为甲醛是吸热反应,(填“放热”或“吸热”),过程Ⅰ与过程Ⅱ的反应热相同(填“相同”或“不同”),E4-E3的含义是降低的活化能值.
(2)工业上用甲烷氧化法合成甲醇的反应有:
①CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
③2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
用CH4和02直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1.
(3)甲醇可用于制备绿色碱性燃料电池,既可提高能源利用率,又利于分环境保护.甲醇、KOH溶液、空气构成的燃料电池工作时负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
(4)用此电池作电源进行模拟工业上精炼铜,则应用粗铜(含Fe、Zn、Ag、Au等杂质)作电解池的阳极,该电极发生反应的电极反应为Cu-2e-=Cu2+,若阴极增重19.2g,则理论上需要甲醇3.2g.
分析 (1)反应物的总能量比生成物的总能量低,为吸热反应,反之为放热反应,通过比较反应物和生成物的总能量的角度来得出反应吸热;反应热取决于反应物和生成物的总能量的大小,与起始状态和反应的最终状态有关,而与反应的途径无关;E4-E3为降低了反应的活化能值;
(2)已知:(i)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(ii)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(iii)2CO(g)+O2(g)?2CO2(g) )△H3=-566.0kJ•mol-1
根据盖斯定律,i×2+2×ii+iii可得:2CH4(g)+O2(g)?2CH3OH(g);
(3)原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水;
(4)电解法精炼铜时,粗铜作阳极,与电源的正极相连,主要反应为铜失去电子,纯铜作阴极,与电源的负极相连;若用该电池电解精炼铜,依据串联电路中各个电极转移电子数相同,依据电子守恒计算理论上需要甲醇的质量.
解答 解:(1)通过图象可以看出,反应物的总能量比生成物的总能量低,故为吸热反应,一个化学反应的热效应仅与反应的起始状态和反应的最终状态有关,与反应的途径无关,仅取决于反应物和生成物的总能量的大小,过程Ⅰ与过程Ⅱ的反应热是相同的,过程Ⅱ与过程Ⅰ比较活化能减小,E4-E3为降低了反应的活化能值,
故答案为:吸热;相同;降低的活化能值;
(2)已知:(i)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(ii)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(iii)2CO(g)+O2(g)?2CO2(g) )△H3=-566.0kJ•mol-1
根据盖斯定律,i×2+2×ii+iii可得:得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制备甲醇蒸气的热化学方程式为2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,
故答案为:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(3)原电池负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(4)电解精炼铜时,粗铜应作阳极,电解池的阴极材料是纯铜,阳极主要电极反应为:Cu-2e-=Cu2+,电极反应为:Cu2++2e-=Cu,Fe、Zn比Cu活泼,故Fe、Zn在阳极比Cu更容易失去电子,变成Fe2+、Zn2+进入溶液;在阴极,Fe2+、Zn2+比Cu2+难于得到电子,因此不能在阴极析出,最终留在溶液中,Cu比Ag、Au活泼,故Ag、Au在阳极比Cu难于失去电子,因此不能溶解进入溶液,最终以阳极泥的形式沉淀出来,所以电解精炼铜,阴极电极反应为:Cu2++2e-=Cu,每转移2mol电子,析出64g铜,所以阴极质量增重19.2g时,转移电子数为:$\frac{19.2g}{64g/mol}$×2=0.6mol,电池与电解池为串联,所以当电解池中转移0.6mol电子,电池中转移电子数为0.6mol,依据CH3OH-6e-+8OH-=CO32-+6H2O可知需0.1mol甲醇,质量为m=nM=0.1mol×32g/mol=3.2g,
故答案为:3.2.
点评 本题主要考查了反应中能量的变化、热化学方程式的书写、电解池工作原理及相关计算,理清甲醇和氢气的热量关系、熟悉原电池、电解池工作原理及各个电极发生反应是解答本题的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Al2(SO4)3═2Al3++3SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++HSO4- | D. | KClO3═K++Cl-+3O2- |
| 1 | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(2)a mol NO完全转化为HNO3理论上需要氧气0.75amol;为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为0.14.
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为HNO3的转化率.
(写出简要计算过程)
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
②下列说法不正确的是C
A.反应I:单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.反应I:若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.反应II:增大压强能使反应速率加快,是因为增加了活化分子百分数
D.恒温恒容条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体达到平衡,NO2体积分数变大.
| A. | 2.0×10-6mol/L | B. | 3.2×10-6mol/L | C. | 2.0×10-9mol/L | D. | 3.2×10-9mol/L |
| A. | 氧化物、化合物 | B. | 化合物、混合物 | C. | 溶液、胶体 | D. | 分散系、胶体 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.