题目内容
为提纯含有少量CaCl2、KBr杂质的KCl,某课外活动小组的同学设计了以下实验方案.
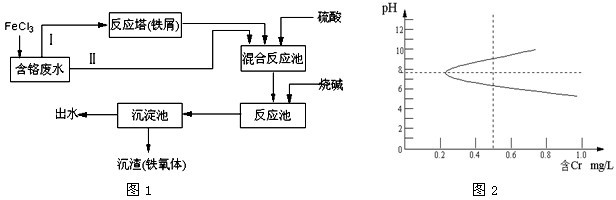
就此实验回答下列问题:
(1)A中的溶质是 ,分离A与B所用的主要仪器是 .
(2)C的化学式是 .
(3)蒸发D得到的固体仍含有 杂质,要得到较纯净的KCl,必须向D中加入 后再进行蒸发.

就此实验回答下列问题:
(1)A中的溶质是
(2)C的化学式是
(3)蒸发D得到的固体仍含有
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:通入过量氯气,氯气把溴置换出来,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,溴易溶于四氯化碳,由于四氯化碳密度比水大,有机层在下层,水溶液在上层,采用分液方法分离,向水溶液中加入过量的碳酸钾,钙离子生成碳酸钙沉淀,过量的碳酸钾和氯化钾留在滤液中,故蒸发得到的是碳酸钾和氯化钾的混合物,因此此实验需加入盐酸除去过量的碳酸钾再蒸发,依此分析解题.
解答:
解:(1)通入过量氯气,氯气把溴置换出来,反应的离子方程式为:Cl2+2Br-=2Cl-+Br2,溴易溶于四氯化碳,故A中溶质为溴单质;分离互不相溶的液体采用分液方法,所用仪器主要为分液漏斗;
故答案为:溴单质;分液漏斗;
(2)溶液B中含钙离子,向B溶液中加入过量的碳酸钾,钙离子生成碳酸钙沉淀,反应的方程式为:Ca2++CO32-=CaCO3↓;
故答案为:CaCO3;
(3)过量的碳酸钾和氯化钾留在滤液中,故蒸发得到的是碳酸钾和氯化钾的混合物,因此此实验需加入稀盐酸除去过量的碳酸钾再蒸发,
故答案为:K2CO3;稀盐酸.
故答案为:溴单质;分液漏斗;
(2)溶液B中含钙离子,向B溶液中加入过量的碳酸钾,钙离子生成碳酸钙沉淀,反应的方程式为:Ca2++CO32-=CaCO3↓;
故答案为:CaCO3;
(3)过量的碳酸钾和氯化钾留在滤液中,故蒸发得到的是碳酸钾和氯化钾的混合物,因此此实验需加入稀盐酸除去过量的碳酸钾再蒸发,
故答案为:K2CO3;稀盐酸.
点评:本题考查了氯化钾的提纯,难度不大,主要除杂加入试剂需过量,过量试剂需除去的原则.

练习册系列答案
相关题目
下列鉴别、分离或除杂方法中正确的是( )
| A、苯中含有少量苯酚,可用NaOH溶液除去 |
| B、NaOH固体中混有NH4HCO3,可直接加热除去NH4HCO3 |
| C、鉴别甲苯与己烯,可滴加酸性KMnO4溶液 |
| D、鉴别某溶液是否含有Fe2+,可先滴加新制氯水,再滴加KSCN溶液 |
下列物质的转化在给定条件下能实现的是( )
①Na
Na2O
Na2O2
②CaCO3
CO2
C
③NaCl(饱和)
NaHCO3
Na2CO3
④Fe
FeCl2
FeCl3.
①Na
| 氧气 |
| 点燃 |
| 氧气 |
| 点燃 |
②CaCO3
| 稀硫酸 |
| Mg |
| 点燃 |
③NaCl(饱和)
| NH3、CO2 |
| △ |
④Fe
| 氯气 |
| 点燃 |
| 氯气 |
| 点燃 |
| A、①④ | B、②③ | C、③ | D、④ |
某无色透明溶液中,能大量共存的离子组是( )
| A、Cu2+、Na+、SO42-、Cl- |
| B、Ba2+、Na+、OH-、SO42- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、K+、Na+、OH-、NO3- |