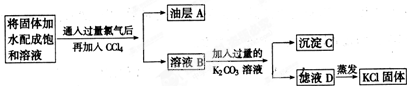
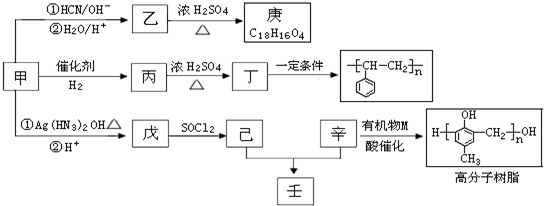
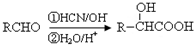
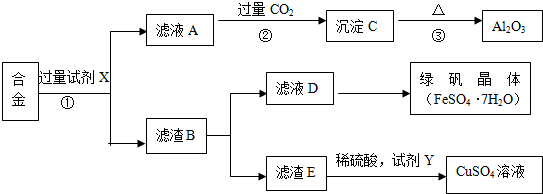
题目内容
六种短周期元素a、b、c、d、e、f,原子序数依次增大.a的核外电子总数与其周期数相同,b的s轨道和p轨道上电子数之比为2:1,c的价电子层中未成对电子有3个,d是地壳中含量最多的元素,e的最外层只有1个电子,f与d同族.回答下列问题;
(1)e的元素名称是 ,b的原子结构示意图为 ,
c、d、e的简单离子半径由大到小的顺序为 (用离子符号填空)
(2)①ba3-da分子内的a-b-a键角 (填“大于”、“等于”或“小于”)ba2d分子内的a-b-a键角.
②a2d的沸点高,是因为它们的分子间存在氢键,请表示出其中的氢键
(3)这些元素形成的常见无机含氧酸中,酸根离子的中心原子的价层电子对数为4的酸是 (任写一种,用化学式填空);酸根离子呈平面三角形结构的酸是 (任写一种,用化学式填空).
(4)已知:bd2与c2d互为等电子体,且c2d中d原子只连1个c原子.试写出c2d的结构式 .
(1)e的元素名称是
c、d、e的简单离子半径由大到小的顺序为
(2)①ba3-da分子内的a-b-a键角
②a2d的沸点高,是因为它们的分子间存在氢键,请表示出其中的氢键
(3)这些元素形成的常见无机含氧酸中,酸根离子的中心原子的价层电子对数为4的酸是
(4)已知:bd2与c2d互为等电子体,且c2d中d原子只连1个c原子.试写出c2d的结构式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:六种短周期元素a、b、c、d、e、f,原子序数依次增大,d是地壳中含量最多的元素,故d为氧,e的最外层只有1个电子,且为短周期元素,原子序数大于O,故e为钠,f与d同族,故f为硫,b的s轨道和p轨道上电子数之比为2:1,故b的s轨道电子数为4,p轨道电子数为2,b的原子序数小于O,故b为碳,c的价电子层中未成对电子有3个,且原子序数小于O,故C为氮,a的核外电子总数与其周期数相同,且原子序数小于C,据此得出a为氢,然后回答各小题即可.
解答:
解:依据分析可知:a为氢,b为碳,c为氮,d为氧,e为钠,f为硫,
(1)e为Na,名称为:钠,b为C,C有2个电子层,最外层4个电子,故C的原子结构示意图为: ;N、O、Na的简单离子核外电子排布相同,故原子序数越小,半径越大,即:N3->O2->Na+,故答案为:钠;
;N、O、Na的简单离子核外电子排布相同,故原子序数越小,半径越大,即:N3->O2->Na+,故答案为:钠; ;N3->O2->Na+;
;N3->O2->Na+;
(2)①CH3-OH分子中,中心原子C原子采取sp3杂化,分子内的H-C-H键角约为109°28′,CH2O分子中,中心C原子采取sp2杂化,分子内的H-C-H键角大约为120°,故答案为:小于;
②H2O的沸点高,是因为水分子间存在氢键,其中的氢键可表示为:O-H…O,故答案为:O-H…O;
(3)C、N、S这些元素形成的常见无机含氧酸为:H2CO3,H2SO4,H2SO3,HNO3等,酸根离子的中心原子的价层电子对数为4的酸是:H2SO4或H2SO3;酸根离子呈平面三角形结构的酸是:HNO3,故答案为:H2SO4,HNO3;
(4)CO2与N2O互为等电子体,N2O中O原子只连1个N原子,故N2O的结构式为:N=N=O,故答案为:N=N=O.
(1)e为Na,名称为:钠,b为C,C有2个电子层,最外层4个电子,故C的原子结构示意图为:
 ;N、O、Na的简单离子核外电子排布相同,故原子序数越小,半径越大,即:N3->O2->Na+,故答案为:钠;
;N、O、Na的简单离子核外电子排布相同,故原子序数越小,半径越大,即:N3->O2->Na+,故答案为:钠; ;N3->O2->Na+;
;N3->O2->Na+;(2)①CH3-OH分子中,中心原子C原子采取sp3杂化,分子内的H-C-H键角约为109°28′,CH2O分子中,中心C原子采取sp2杂化,分子内的H-C-H键角大约为120°,故答案为:小于;
②H2O的沸点高,是因为水分子间存在氢键,其中的氢键可表示为:O-H…O,故答案为:O-H…O;
(3)C、N、S这些元素形成的常见无机含氧酸为:H2CO3,H2SO4,H2SO3,HNO3等,酸根离子的中心原子的价层电子对数为4的酸是:H2SO4或H2SO3;酸根离子呈平面三角形结构的酸是:HNO3,故答案为:H2SO4,HNO3;
(4)CO2与N2O互为等电子体,N2O中O原子只连1个N原子,故N2O的结构式为:N=N=O,故答案为:N=N=O.
点评:本题主要考查的是元素的推断以及离子半径大小比较、键角大小比较、结构式的确定等,综合性较强,有一定难度.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
2013年1月28日日本岛发生火山喷发,将滚热的云状火山气体和火山灰喷向高空.火山气体主要包括①水蒸气②CO2③SO2④SO3⑤HCl,这些气体对环境造成了极大的危害,对①~⑤中的相关气体的叙述中不正确的是( )
| A、收集一定量的火山气体通入足量BaCl2溶液中,只能生成BaSO4一种沉淀 |
| B、②③④属于酸性氧化物 |
| C、⑤属于强电解质 |
| D、①②③④属于非电解质 |