题目内容
3.向100mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol/L的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.下列说法正确的是( )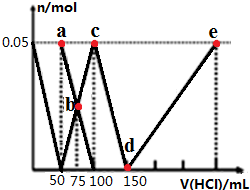
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL.
据此结合选项解答.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸.
首先,发生反应AlO2-+H++H2O═Al(OH)3↓,最左边曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知n(AlO2-)=n(H+)=0.05L×1mol/L=0.05mol.
第二阶段,AlO2-反应完毕,发生反应CO32-+H+═HCO3-,ab线表示CO32-,bc线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知n(CO32-)=n(H+)=0.05L×1mol/L=0.05mol.
第三阶段,CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,cd线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+).
第四阶段,发生反应Al(OH)3+3H+═Al3++3H2O,de线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL.
A.由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为0.05mol:0.05mol=1:1,故A正确;
B.a点溶液中,溶质为Na2CO3,由质子守恒可知:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),故B错误;
C.b点碳酸钠和碳酸氢钠的浓度相等,加入了75mL盐酸,碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-),故C正确;
D.d→e的过程中铝离子的浓度逐渐增大,铝离子水解促进了水的电离,则该段水的电离程度逐渐增大,故D错误.
故选:AC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用能力.

| A. | 元素最高化合价的顺序为Z>Y>T>X | |
| B. | Y、Z分别形成的简单氢化物的稳定性为Z>Y | |
| C. | 由X、Y和Z三种元素构成的强电解质,对水的电离均起抑制作用 | |
| D. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液不能反应 |
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
①10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
| 沸点 | 溶解性 | 着火点(闪点) | 毒性 | |
| 丙烯酸 | 142℃ | 与水互溶,易溶于有机溶剂 | 54℃ | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 11℃ | 有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 不详 | 无毒 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
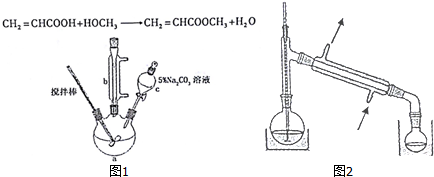
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①%2油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验.防止明火.
 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为N2H4+2O2═2NO+2H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
| 序号 | 操作和现象 | 结论 |
| A | 向某溶液中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量浓NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中含NH4+ |
| C | 常温下,测得饱和NaA溶液的pH大于饱和NaB溶液 | 常温下水解程度:A->B- |
| D | 向蔗糖溶液中滴加少量稀H2SO4,水浴加热;向其中滴加少量新制Cu(OH)2悬浊液,加热,无明显现象 | 蔗糖没有水解 |
| A. | A | B. | B | C. | C | D. | D |
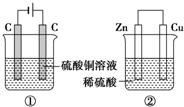 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则: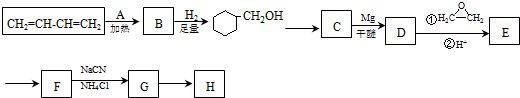

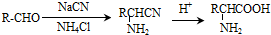
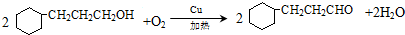 .
.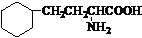 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式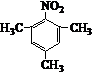 、
、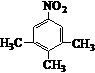 .
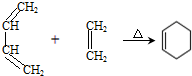
.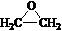 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).