题目内容
13.已知酸性强弱顺序为H2CO3>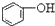 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )| A. | 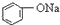 +H2O+CO2→ +H2O+CO2→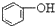 +Na2CO3 +Na2CO3 | B. | 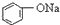 +NaHCO3→ +NaHCO3→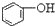 +Na2CO3 +Na2CO3 | ||
| C. | 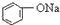 +H2O+CO2→ +H2O+CO2→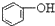 +NaHCO3 +NaHCO3 | D. | 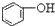 +NaHCO3→ +NaHCO3→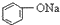 +H2O+CO2 +H2O+CO2 |
分析 已知酸性强弱顺序为H2CO3> >HCO3-,强酸能和弱酸的盐发生复分解反应生成弱酸,据此分析解答.
>HCO3-,强酸能和弱酸的盐发生复分解反应生成弱酸,据此分析解答.
解答 解:强酸能和弱酸的盐发生复分解反应生成弱酸,酸性强弱顺序为H2CO3> >HCO3-,
>HCO3-,
A.酸性H2CO3> >HCO3-,所以苯酚钠和二氧化碳、水反应生成苯酚钠和碳酸氢钠,方程式为
>HCO3-,所以苯酚钠和二氧化碳、水反应生成苯酚钠和碳酸氢钠,方程式为 ,故A错误;
,故A错误;
B.酸性 >HCO3-,所以苯酚和碳酸钠会发生反应生成苯酚钠和碳酸氢钠,反应方程式为
>HCO3-,所以苯酚和碳酸钠会发生反应生成苯酚钠和碳酸氢钠,反应方程式为 ,即苯酚和碳酸钠不会同时产生,故B错误;
,即苯酚和碳酸钠不会同时产生,故B错误;
C.酸性H2CO3> >HCO3-,所以苯酚钠和二氧化碳、水反应生成苯酚钠和碳酸氢钠,方程式为
>HCO3-,所以苯酚钠和二氧化碳、水反应生成苯酚钠和碳酸氢钠,方程式为 ,故C正确;
,故C正确;
D.酸性 >HCO3-,所以苯酚和碳酸氢钠不反应,故D错误;
>HCO3-,所以苯酚和碳酸氢钠不反应,故D错误;
故选C.
点评 本题考查酸性强弱比较,明确强酸制取弱酸性质及常见酸的酸性相对强弱是解本题关键,注意苯酚和二氧化碳、水反应生成碳酸氢钠而不是碳酸钠,为易错点.

练习册系列答案
相关题目
3.下列各物质中属于同分异构体的是( )
| A. | 石墨与金刚石 | B. |  与 与  | C. |  与 与  | D. |  与 与 |
4.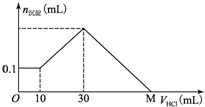 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )| A. | 70 mL | B. | 100 mL | C. | 120 mL | D. | 130 mL |
1.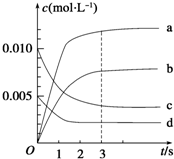 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
(1)能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
18.下列离子方程式书写不正确的是( )
| A. | 往氯化铝溶液中滴加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往澄清石灰水中通入过量CO2:CO2+OH-=HCO3- | |
| D. | 铁粉和浓盐酸反应:Fe+2H+=Fe2++H2↑ |
5.下列是某同学的设计的家庭小实验,其中不能成功的是( )
| A. | 用小苏打检验面团发酵产生的酸 | |
| B. | 用碘酒证明马铃薯中含有淀粉 | |
| C. | 用食醋除去热水瓶中的水垢 | |
| D. | 用淀粉直接检验加碘盐中含的碘元素 |
2.已知下列反应,其中必须加入氧化剂才能实现的是( )
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Fe3+→Fe2+ |
3.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 硅酸钠溶液中滴加稀盐酸:SiO32-+2H+═H2SiO3↓ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |


 .
.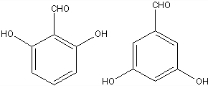 、
、 (任意一种).
(任意一种).