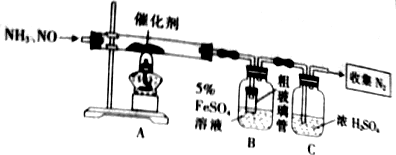
题目内容
18.许多国家十分重视海水资源的综合利用.不需要化学变化就能够从海水中获得的物质是( )| A. | 溴、碘 | B. | 镁、铝 | C. | 烧碱、氢气 | D. | 食盐、淡水 |
分析 根据从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到.
解答 解:A.从海水中提炼溴和碘,是用氯气把其中的碘离子和溴离子氧化为碘单质和溴单质,故A错误;
B.海水中得到镁,需要首先从海水中获得氯化钠和氯化镁,然后再去电解熔融状态的氯化钠和氯化镁即得镁,铝需要电解氧化铝得到,故B错误;
C.可从海水中获得氯化钠,然后电解饱和食盐水,即得烧碱、氢气和氯气,故C错误;
D.把海水用蒸馏等方法可以得到淡水,把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故D正确;
故选D.
点评 本题考查了海水的成分,海水提炼溴、碘、钠、镁、氢气等化学反应原理,涉及的知识较多,是一道综合性较强,但难度不大的题目,考试时经常用这类题目来考查基本知识.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
9.电解是工业生产的常用方法.某研究性小组进行以下相关探究:
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu(填化学式);或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.(用含m、n、v的式子表示)
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu(填化学式);或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{{W}_{1}-{W}_{2}}{35.5}$.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.(用含m、n、v的式子表示)
6. 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A. | a、c两点沉淀物成份不相同,d、e两点沉淀物成份相同 | |
| B. | b点溶液的中c(Na+)=c(C1-) | |
| C. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| D. | 在d点,向溶液中加入少量盐酸,沉淀量将减少 |
3.下列反应的离子方程式正确的是( )
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氧化铝溶于氢氧化钠:Al2O3+2OH-═2AlO2-+H2↑ | |
| C. | 硅酸钠溶液中滴加稀盐酸:SiO32-+2H+═H2SiO3↓ | |
| D. | 澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
10.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是( )


| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
7.下列每组分别给出了两个量,其中可以组成一个物质的量的公式的组有( )
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |


 .
.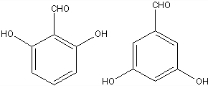 、
、 (任意一种).
(任意一种).