题目内容
20. 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 图2是滴定盐酸的曲线 | |
| B. | 图1滴定时应该选择酚酞做指示剂 | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) |
分析 A.盐酸为强酸,0.1000mol•L-1盐酸pH=1;
B.氢氧化钠滴定醋酸,滴定终点溶液呈碱性;
C.如恰好反应,溶液呈碱性,pH>7;
D.如滴加较少NaOH,可能存在c(H+)>c(Na+).
解答 解:A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图2,故A正确;
B.氢氧化钠滴定醋酸,滴定终点溶液呈碱性,可用酚酞为指示剂,故B正确;
C.如恰好反应,溶液呈碱性,pH>7,而B点时呈碱性,则V(NaOH)<V(HA),故C正确;
D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选D.
点评 本题考查离子浓度大小比较、酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及盐类的水解和溶液离子浓度的大小比较等知识,注意根据电荷守恒、物料守恒进行判断离子浓度大小,题目有利于培养学生的分析能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
8.关于如图所示装置的叙述,正确的是( )
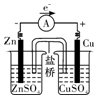

| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电流方向从锌片经导线流向铜片 | D. | 铜离子在铜片表面被还原 |
15.下列有关化学用语能确定为丙烯的是( )
| A. |  | B. | C3H6 | C. |  | D. | CH2═CHCH3 |
5.已知0.1mol•L-1NaHSO3溶液显酸性,且c(SO32-)<c(HSO3-),下列措施不能使溶液中c(SO32-)=c(HSO3-)>0的是.( )
| A. | 加入少量新制氯水 | B. | 加入一定量的小苏打溶液 | ||
| C. | 加入一定量的氢氧化钡固体 | D. | 加入一定量的Na2SO3固体 |
9.浓度均为1mol/LNaCl溶液、MgCl2溶液、AlCl3三种溶液中,它们的氯离子的物质的量浓度分别是( )
| A. | 1mol/L 1mol/L 1mol/L | B. | 1mol/L 4mol/L 9mol/L | ||
| C. | 1mol/L 2mol/L 3mol/L | D. | 体积未知,无法确定 |
10. 现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )
现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )
 现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )
现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )| A. | Al、Mg、SiO2、Zn | B. | Al、Fe、Zn、Na | C. | Al、Na、Cu、Fe | D. | Al、Cu、Mg、Si |