题目内容
5.已知0.1mol•L-1NaHSO3溶液显酸性,且c(SO32-)<c(HSO3-),下列措施不能使溶液中c(SO32-)=c(HSO3-)>0的是.( )| A. | 加入少量新制氯水 | B. | 加入一定量的小苏打溶液 | ||
| C. | 加入一定量的氢氧化钡固体 | D. | 加入一定量的Na2SO3固体 |
分析 NaHSO3溶液中存在HSO3-?H++SO32-,溶液显酸性,且c(SO32-)<c(HSO3-),说明HSO3-电离程度大于水解程度,使溶液中c(SO32-)=c(HSO3-)>0,应促进HSO3-的电离,以此解答该题.
解答 解:A.加入少量新制氯水,可氧化HSO3-生成SO42-,溶液酸性增强,可生成二氧化硫气体,故A错误;
B.小苏打溶液呈碱性,利于平衡正向移动,可使c(SO32-)=c(HSO3-),故B正确;
C.加入一定量的氢氧化钡固体,可是平衡正向移动,且生成亚硫酸钡沉淀,发生Ba(OH)2+NaHSO3=BaSO3↓+NaOH+H2O,且NaOH再与NaHSO3反应生成SO32-,可能使c(SO32-)=c(HSO3-),故C正确;
D.加入一定量的Na2SO3固体,c(SO32-)增大,可使c(SO32-)=c(HSO3-),故D正确.
故选A.
点评 本题考查化学平衡,为高频考点,侧重分析与应用能力的考查,注意把握物质的性质以及电离平衡的影响因素,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.需要有适当的氧化剂才能实现的反应是( )
| A. | FeCl2→FeCl3 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | H2O2→H2O |
20.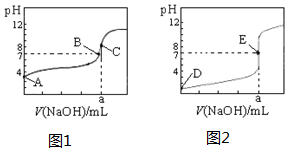 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 图2是滴定盐酸的曲线 | |
| B. | 图1滴定时应该选择酚酞做指示剂 | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) |
10.实验室中配制250mL 0.10mol•L-1NaOH溶液时,必须使用到的玻璃仪器是( )
| A. |  锥形瓶 | B. |  试管 | C. |  分液漏斗 | D. | 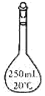 容量瓶 |
17.当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是( )
| A. | AgI比AgCl稳定 | B. | 氯的非金属性比碘强 | ||
| C. | I-的还原性比Cl-强 | D. | AgI的溶解度比AgCl小 |
14.原子序数依次增大的前20号元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦原子相同,b和c的次外层均有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | 元素的非金属性强弱:c>b | |
| B. | 元素a和其他3种元素均能形成共价化合物 | |
| C. | 元素d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
15.下列说法不正确的是( )
| A. | 两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | |
| B. | 常温下,浓度均为0.1mol/L①醋酸、②盐酸、③醋酸钠溶液,水电离程度的顺序为③>①>② | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 物质的浓度相同的①氯化铵溶液、②硫酸钠溶液、③碳酸氢钠溶液,pH的顺序为:③>①>② |
