题目内容
15.下列有关化学用语能确定为丙烯的是( )| A. |  | B. | C3H6 | C. |  | D. | CH2═CHCH3 |
分析 丙烯的结构简式为:CH2═CH-CH3,电子式为: ,为分子式,但不能确定,以此解答该题.
,为分子式,但不能确定,以此解答该题.
解答 解:A.球棍模型 中不一定由C、H两种元素组成,所以不一定为丙烯,故A错误;
中不一定由C、H两种元素组成,所以不一定为丙烯,故A错误;
B.C3H6有丙烯、环丙烷(键线式为△)烷两种结构,所以不一定为丙烯,故B错误;
C.丙烯的电子式为: ,选项中丙烯的电子式书写错误,故C错误;
,选项中丙烯的电子式书写错误,故C错误;
D.丙烯的结构简式为:CH2═CH-CH3,书写正确,故D正确.
故选D.
点评 本题考查化学用语,为高频考点,侧重考查学生对双基知识的掌握,明确丙烯的结构特点是解题关键,注意球棍模型、电子式、分子式、结构简式表示的方法,题目难度不大.

练习册系列答案
相关题目
6. 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
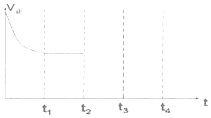
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1molCO2的同时消耗了1molCO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强或向容器中充入CO气体.(任写1个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△HZZ=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”、“低温”或“任意温度”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1=9.1×10-8;Ka2=1.1×10-12.H2CO3:Ka1=4.3×10-7;Ka2=5.6×10-11.)
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据
①实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b.
②若在900℃时,另做一组实验,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时V正<V逆(填“<”,“>”,“=”).
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是CD.
A.在单位时间内生成1molCO2的同时消耗了1molCO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
③若要同时提高该反应的速率和NO的转化率,采取的措施有增大压强或向容器中充入CO气体.(任写1个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△HZZ=+131.3kJ•mol-1
①该反应在高温下能自发进行(填“高温”、“低温”或“任意温度”).
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为CO32-+H2S=HCO3-+HS-.(已知:H2S:Ka1=9.1×10-8;Ka2=1.1×10-12.H2CO3:Ka1=4.3×10-7;Ka2=5.6×10-11.)
(3)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若在900℃时,另做一组实验,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时V正<V逆(填“<”,“>”,“=”).
3.从下列实验事实得出的结论中,不正确的是( )
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
| D | 某溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀 | 该溶液中含有Cl- |
| A. | A | B. | B | C. | C | D. | D |
10.下列有关水在人体中的作用的说法不正确的是( )
| A. | 水能调节人体体温 | B. | 水在人体内分解会放出热量 | ||
| C. | 水是人体内进行生化反应的介质 | D. | 水在人体内是一种良好的溶剂 |
20.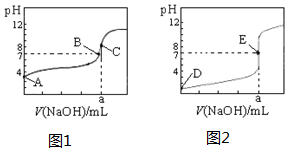 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 图2是滴定盐酸的曲线 | |
| B. | 图1滴定时应该选择酚酞做指示剂 | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) |
7.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
4.一定条件下恒容容器内反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmol A2,同时生成2n mol AB | |
| B. | 反应混合气体总压强不随时间而变化 | |
| C. | 反应混合气体密度不随时间而变化 | |
| D. | 容器中各组分的质量分数不随时间而变化 |
5.下列离子或分子在溶液中能大量共存且满足相应要求的是( )
| 选项 | 离子或分子 | 要求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| C | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| D | Fe3+ Na+、NO3-、ClO- | 溶液pH=l |
| A. | A | B. | B | C. | C | D. | D |