题目内容
12.金属钠的化学性质很活泼,它在空气中很容易变质,可以与冷水发生剧烈反应.(1)钠在上述空气、冷水中发生反应中失填“得”或“失”)电子,表现出还原性(填“氧化”或“还原”).
(2)写出钠与水反应的化学方程式2Na+2H2O=H2↑+2NaOH.
(3)金属钠与水反应的实验中,体现出钠的物理性质有密度小,熔点低.
(4)当有0.2mol钠发生反应时,生成氢气的体积为2.24L(标准状况)
分析 (1)钠在反应中易失电子作还原剂;
(2)钠与水反应生成氢氧化钠和氢气;
(3)钠与水反应时,钠浮在水面上,且不断熔化;
(4)根据钠与水反应的方程式计算.
解答 解:(1)钠最外层有1个电子,所以钠在反应中易失电子作还原剂,体现还原性,故答案为:失;还原;
(2)钠和水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=H2↑+2NaOH,
故答案为:2Na+2H2O=H2↑+2NaOH;
(3)钠与水反应时,钠浮在水面上,且不断熔化,说明熔点低,故答案为:密度小,熔点低;
(4)反应的方程式为2Na+2H2O=H2↑+2NaOH,可知0.2mol钠生成0.1mol氢气,体积为2.24L,故答案为:2.24L.
点评 本题综合考查钠的性质,为高频考点,侧重考查学生的双基知识,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.把铁粉、铜粉置于FeCl3溶液中,充分反应后溶液中仍有红色粉末存在,则关于反应后溶液中的金属阳离子的判断正确的是( )
| A. | 一定有Fe2+和Cu2+ | B. | 一定有Fe2+,Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
3.从下列实验事实得出的结论中,不正确的是( )
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
| D | 某溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀 | 该溶液中含有Cl- |
| A. | A | B. | B | C. | C | D. | D |
20.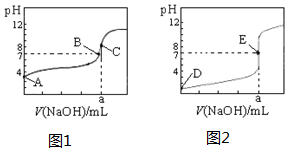 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 图2是滴定盐酸的曲线 | |
| B. | 图1滴定时应该选择酚酞做指示剂 | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) |
7.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
17.当固体AgCl放在较浓的KI溶液中振荡时,部分AgCl转化为AgI,其原因是( )
| A. | AgI比AgCl稳定 | B. | 氯的非金属性比碘强 | ||
| C. | I-的还原性比Cl-强 | D. | AgI的溶解度比AgCl小 |
4.一定条件下恒容容器内反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是( )
| A. | 单位时间内生成nmol A2,同时生成2n mol AB | |
| B. | 反应混合气体总压强不随时间而变化 | |
| C. | 反应混合气体密度不随时间而变化 | |
| D. | 容器中各组分的质量分数不随时间而变化 |
1.下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
| A. |  闻气体的气味 | B. |  用浓硫酸干燥CO2 | ||
| C. |  向容量瓶中转移液体 | D. |  用海水提取淡水 |