题目内容
中和10mL1.0mol/L的盐酸,需用等体积的NaOH溶液和氨水,则NaOH和氨水的( )
| A、C (OH-)相同 |
| B、pH值相同 |
| C、溶质的质量相同 |
| D、溶质的物质的量相同 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据盐酸和碱反应的量的关系:HCl~NaOH;HCl~NH3?H2O,氨水是弱碱,不能完全电离,氢氧化钠是强碱,能完全电离,据此计算即可.
解答:
解:根据盐酸和碱反应的量的关系:HCl~NaOH;HCl~NH3?H2O,所以中和10mL1.0mol/L的盐酸,需用NaOH和氨水的物质的量是相等的,二者的体积相等,所以二者的物质的量浓度相等,氨水是弱碱,不能完全电离,氢氧化钠是强碱,能完全电离,二者物质的量浓度相等时,氢氧根离子浓度不同,pH不同,二者的质量也不相等.
故选D.
故选D.
点评:本题涉及弱电解质在水溶液中的电离平衡的应用知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各有机化合物的命名正确的是( )
| A、CH2═CH-CH═CH2 1,3二丁烯 |
B、 3-丁醇 3-丁醇 |
C、 3,4,4-三甲基己烷 3,4,4-三甲基己烷 |
D、 2-甲基丁烷 2-甲基丁烷 |
下列各组物质中,属于同分异构体的是( )
| A、O2和O3 |
B、 和CH3CH=CHCH3 和CH3CH=CHCH3 |
C、 和CH2=CHCH3 和CH2=CHCH3 |
| D、CH3CH2OH和CH3OCH3 |
下列叙述错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解反应通常为吸热反应 |
| D、盐类水解是指组成盐的离子跟水电离出的H+或OH-离子生成弱电解质的反应 |
下列叙述不正确的是( )
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、电泳现象可证明胶体粒子是带电荷的 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、胶体粒子很小,不能透过半透膜 |
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、3.4g NH3中含NH3分子数目为0.2NA |
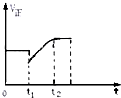 如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A、t1时只减小了压强 |
| B、t1时只降低了温度 |
| C、t1时减小了NH3的浓度,平衡向正反应方向移动 |
| D、t1时减小N2浓度,同时增加了NH3的浓度 |
下列有关常见有机化合物的说法正确的是( )
| A、将一小块金属钠投入无水乙醇中,钠块浮在液面上四处游动 |
| B、NaHCO3溶液可用于区分乙酸、乙醇和苯 |
| C、工业上,用乙醇和浓硫酸共热到170℃制取乙烯 |
| D、天然气的主要成分为甲烷,属于可再生能源 |