题目内容
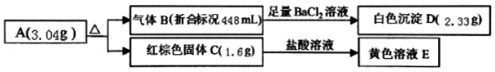
17.常温常压下,将H2S和O2的混合气体100mL引入反应器中在一定条件下充分反应,恢复到原状况,发现尚留气体25mL.则原混合气体中H2S和O2的体积比为( )| A. | 1:1 | B. | 4:3 | C. | 3:1 | D. | 3:2 |
分析 H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,据此讨论,若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余;若n(H2S):n(O2)=2:1,发生反应①,没有气体;若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,气体为氧气、二氧化硫;若n(H2S):n(O2)=2:3,发生反应②,气体为二氧化硫;若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,据此进行计算.
解答 解:H2S和O2的混合气体点燃,氧气不足发生反应①2H2S+O2═2S↓+2H2O,氧气足量发生反应②2H2S+3O2═2SO2+2H2O,
若n(H2S):n(O2)>2:1,发生反应①,H2S有剩余,则:
2 H2S+O2═2 S↓+2 H2O 体积变化△V;
2 1 3
50ml 25ml 100mL-25mL=75mL
剩余气体为25mLH2S,原混合气体中O2为25mL,H2S为:100mL-25mL=75mL,符合题意;
若n(H2S):n(O2)=2:1,发生反应①,没有剩余气体,不符合题意;
若n(H2S):n(O2)<2:3,发生反应②,氧气有剩余,则:
2 H2S+3 O2═2 SO2+2H2O 体积变化△V;
2 3 2 3
50mL 75mL 50mL 100mL-25mL=75mL
剩余气体为氧气、二氧化硫,其中二氧化硫为50mL,不符合题意;
若n(H2S):n(O2)=2:3,发生反应②,最后气体为二氧化硫,体积为50mL,不符合题意;
若2:3<n(H2S):n(O2)<2:1,发生反应①②,气体为二氧化硫,则:
2 H2S+3 O2═2 SO2+2H2O
25mL 37.5mL 25mL
发生反应①的气体体积为:100mL-25mL-37.5mL=37.5mL,其中消耗硫化氢的体积为:37.5mL×$\frac{2}{3}$=25mL,反应消耗氧气的体积为:37.5mL×$\frac{1}{3}$=12.5mL,
所以原混合气体中硫化氢的总体积为:25mL+25mL=50mL,氧气的总体积为:37.5mL+12.5mL=50mL,
剩余气体为H2S,原混合气体中可能含有O225mL、H2S75mL,此时H2S和O2的体积比为3:1;剩余气体为二氧化硫,则H2S为50mL,氧气为50mL,此时两者的量之比为1:1,
故选:AC.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意讨论法、差量法在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

| A. | N2+3H2 $?_{高温高压}^{催化剂}$2NH3 | B. | 2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2 | ||
| C. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl | D. | C2H4+H2$\frac{\underline{\;催化剂\;}}{\;}$C2H6 |
| A. | X单质与M单质不能直接化合 | |
| B. | Y的合金可用作航空航天飞行器材料 | |
| C. | M简单离子半径大于Y2+的半径 | |
| D. | X和Z的气态氢化物,前者更稳定 |
| A. | 室温时,0.1 mol•L-1某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 | |
| B. | 反应CO(g)+3H2(g)=CH4(g)+H2O(g)一定条件下可自发进行,则该反应的△H>0 | |
| C. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| D. | 为减小中和滴定误差,锥形瓶和滴定管必须洗净并润洗后才能使用 |
| A. | 5.8g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA | |
| B. | 1mol CnH2n-2(n≥2)中所含的共用电子对数为(3n+1)NA | |
| C. | 60克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA |
| A. | 向MgCl2溶液中滴加过量氨水:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu═2Fe+3Cu2+ | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
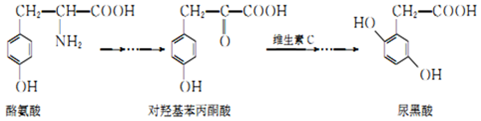
下列说法错误的是( )
| A. | 酪氨酸既能与盐酸反应,又能与NaOH溶液反应 | |
| B. | 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子 |
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示: