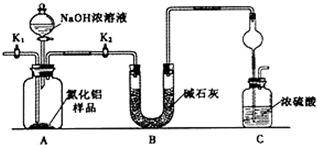
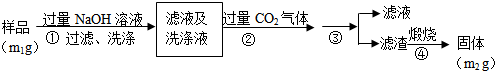
题目内容
9.在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Na+、K+、Fe3+、NH4+、H+、Cl-、NO3-、OH-、S2-、MnO4-、SO42-、AlO2-、CO32-,且两溶液里所含离子不相同,已知M溶液中的阳离子只有两种,则N溶液中的阴离子应该是( )| A. | NH4+ S2- CO32- | B. | AlO21 SO42- MnO4- | ||
| C. | NO3- Cl- SO42- | D. | MnO4- SO42- NO3- |
分析 两溶液里所含离子不相同,已知M溶液中的阳离子只有两种,则由H+、NH4+、Fe3+、Al3+均能与OH-反应,则M中的阳离子为K+、Na+,N中的阳离子为H+、NH4+、Fe3+、Al3+,则与N中阳离子反应的阴离子应在M中,剩余的阴离子在N中,以此来解答.
解答 解:由溶液中离子之间的反应可知,Al3+、Fe3+、NH4+、H+与OH-,不能大量共存,且M溶液里的阳离子只有两种,所以Al3+、Fe3+、NH4+、H+在N溶液中,OH-在M溶液中,由此知,M溶液呈碱性,N溶液呈酸性;
N溶液呈酸性,能和酸反应的离子AlO2-、CO32-、S2-不能在N溶液中,只能在M溶液中,高锰酸根离子有强氧化性,不能和氯离子、硫离子共存,所以氯离子和硫离子存在于M溶液中,M溶液里的阳离子只有两种,Na+、K+也在M溶液中,M、N两溶液各含下列14种离子中的7种,所以NO3-、SO42-在N溶液中;
由以上分析知,M溶液中存在的离子为:Cl-、Na+、K+、OH-、S2-、AlO2-、CO32-.
N溶液中存在的离子为:Al3+、NO3-、MnO4-、Fe3+、NH4+、SO42-、H+.
故选:D.
点评 本题考查离子的共存及离子检验,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意M中阳离子为推断关键,题目难度不大.

练习册系列答案
相关题目
17.如表实验操作可以达到目的是( )
| 目的 | 操作 | |
| A | 干燥Cl2 | 将气体通过盛有碱石灰的干燥装置 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 测定混有NaCl的Na2CO3固体样品中Na2CO3的质量分数 | 取m1g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| D | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
20.常溫下,下列关于电解质溶液的说法正确的是( )
| A. | 某醋酸溶液的pH=a.将此溶液稀释10倍后,溶液的pH值为b.则b=a+1 | |
| B. | CH3OOH和CH3COONa混合溶液不可能存在:c (CH3COOH)>c (CH3COO-)>c (H+)>c (Na+)>c (0H-) | |
| C. | 常温下.将pH=3的H2SO4和pH=11的一元碱BOH-溶液等体积混合,所得溶液可能为中性或酸性 | |
| D. | 常溫下,浓度均为O.1mol•L-1的①CH3COOH溶液②NaOH溶液③CH3OONa 溶液中,水的电离程度③>①>② |
17.E和F是主族元素,下列叙述一定能说明金属性E大于F的是( )
| A. | 最外层电子数:E>F | |
| B. | 等物质的量的E和F分别与足量稀盐酸反应,产生氢气的物质的量:E>F | |
| C. | Ea+和Fb+有相同的电子层结构(a<b) | |
| D. | 25℃时,Ksp[E(OH)a]>Ksp[F(OH)b] |
14.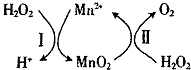 锰的化合物是优良的催化剂,可用于干电池原料生产等.
锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为+3.
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为ZnS(填化学式).[已知Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1,其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2.写出反应 I的热化学方程式(焓变用△H1和△H2表示):H2O2(1)+Mn2+(aq)=2H+(aq)+MnO2(s)△H=△H1-△H2.
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
0~2min时反应速率比2~4min时的快,其原因是随着反应的进行,H2O2浓度不断减小,反应速率不断减慢,0~6min的平均反应速率v(H2O2)=3.3×10-2mol/(L•min)(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
①反应I的正反应是放热(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
 锰的化合物是优良的催化剂,可用于干电池原料生产等.
锰的化合物是优良的催化剂,可用于干电池原料生产等.(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为+3.
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为ZnS(填化学式).[已知Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1,其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2.写出反应 I的热化学方程式(焓变用△H1和△H2表示):H2O2(1)+Mn2+(aq)=2H+(aq)+MnO2(s)△H=△H1-△H2.
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
| t/min | 0 | 2 | 4 | 6 |
| V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
| 反应 | 平衡常数KP | |
| 773K | 873K | |
| Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2(g) | 19.4 | 0.803 |
| Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
②反应Ⅱ的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
1.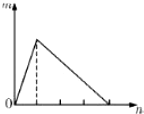 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )| A | B | C | D | |
| X | Ba(OH)2 | NaOH | NH3 | HCl |
| Y | 明矾 | AlCl3 | MgSO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
18.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
19.解释下列事实的方程式不正确的是( )
| A. | Al溶于NaOH溶液:2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向FeCl3溶液中滴加淀粉碘化钾溶液,溶液变蓝:2Fe3++2I-═2Fe2++I2 | |
| D. | 红热的Fe丝与水接触,表面形成蓝黑色保护层:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2↑ |