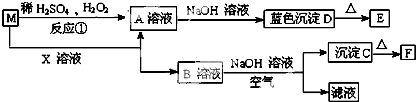
题目内容
某酸性溶液中存在较多的Fe3+,则溶液中还可能大量存在的离子组是( )
| A、OH-、Cl-、Na+ |
| B、SO42-、Cl-、NH4+ |
| C、ClO-、HCO3-、K+ |
| D、I一、Fe2+、Ba2+ |
考点:离子共存问题
专题:离子反应专题
分析:酸性条件下,Fe3+具有强氧化性,与Fe3+发生氧化还原反应,与H+反应的离子不能够大量共存,以此解答该题.
解答:
解:A.酸性条件下OH-不能大量共存,故A错误;
B.酸性条件下,离子之间不发生任何反应,且与Fe3+、H+不发生任何反应,可大量共存,故B正确;
C.酸性条件下,ClO-、HCO3-不能大量共存,且与Fe3+发生互促水解反应,故C错误;
D.酸性条件下,Fe3+与I一发生氧化还原反应而不能大量共存,故D错误.
故选B.
B.酸性条件下,离子之间不发生任何反应,且与Fe3+、H+不发生任何反应,可大量共存,故B正确;
C.酸性条件下,ClO-、HCO3-不能大量共存,且与Fe3+发生互促水解反应,故C错误;
D.酸性条件下,Fe3+与I一发生氧化还原反应而不能大量共存,故D错误.
故选B.
点评:本题考查离子共存,该题是高考中的高频题,为高频考点,侧重于学生的分析能力的考查,属于中等难度的试题,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法中不正确的是( )
| A、汽油和水、CCl4和水两组物质,都能用分液漏斗进行分离 |
| B、在1L 5.0mol/L HCl溶液中取出了10 mL,取出的HCl溶液其浓度为5.0 mol/L |
| C、分散系根据分散质粒子大小可分为溶液、胶体、浊液 |
| D、0.5 molCuO的摩尔质量为40g/mol |
可逆反应2SO2+O2?2SO3 在密闭容器中进行,下列有关说法中错误的是( )
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
在80g密度为dg/cm3的硫酸铁溶液中,含有2.8gFe3+,则此溶液中SO42-的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列对H2(g)+Cl2(g)═2HCl(g)△H(298K)=-184.6kJ?mol-1的叙述正确的是( )
| A、1分子H2和Cl2反应,放出热量184.6 kJ |
| B、1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ |
| C、在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ |
| D、在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
下列叙述正确的是( )
| A、工业上用氯气通入纯碱溶液来生产漂白粉 | ||||
B、工业制硫酸的生产过程中,硫元素的转化步骤是:FeS2
| ||||
| C、高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 | ||||
| D、在海水中加人石灰乳可得氢氧化镁沉淀,这是从海水中富集镁的基本方法 |
 观察下列结构简式,回答下列问题:
观察下列结构简式,回答下列问题: