题目内容
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.(1)一定条件下,N2O5可发生分解反应:2N2O5 (g)?4NO2(g)+O2(g)△H>0
①该反应的平衡常数表达式为K=
②若分别在T1和T2温度下进行该反应(其他条件均相同)测得平衡时NO2浓度分别为2.48mol?L-1和4.98mol?L-1,则反应温度T1
③反应达平衡后,保持容器的体积不变,若再通入一定量氮气,则N2O5的转化率将
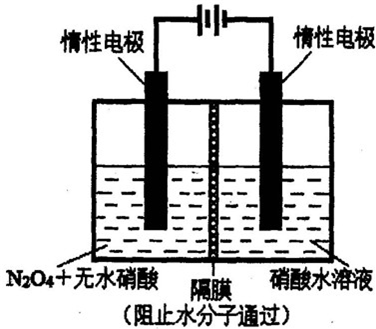
(2)图所示装置可用于电解法制备N2O5.
①生成N2O5的电极反应式为
②已知该电解池的阴极反应为:NO3-+2H++e-=NO2↑+H2O,则通过隔膜定向移动的离子是
③若阴极区收集到标准状况下22.4L气体(不考虑气体的溶解)时,则可制得N2O5
考点:化学平衡常数的含义,化学平衡建立的过程,化学平衡的影响因素,电解原理
专题:基本概念与基本理论
分析:(1)①平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
②该反应正方向为吸热反应,升高温度N2O5的浓度减小;温度升高,化学平衡向正反应方向进行,生成物浓度增大,据此判断K的大小;
③在恒容密闭容器中,通入与反应无关的气体,原平衡不移动;
(2)①由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
②根据电解池阴极反应的离子和电解池工作原理,判断离子的移动;
③根据得失电子数相等,计算出生成的N2O5物质的量.
②该反应正方向为吸热反应,升高温度N2O5的浓度减小;温度升高,化学平衡向正反应方向进行,生成物浓度增大,据此判断K的大小;
③在恒容密闭容器中,通入与反应无关的气体,原平衡不移动;
(2)①由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
②根据电解池阴极反应的离子和电解池工作原理,判断离子的移动;
③根据得失电子数相等,计算出生成的N2O5物质的量.
解答:
解:(1)①2N2O5 (g)?4NO2(g)+O2(g),平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
,故答案为:K=
;
②△H>0,正反应方向吸热,即生成物浓度大,温度越高,T1和T2温度时,NO2浓度分别为2.48mol?L-1和4.98mol?L-1,后者高于前者,可知T1<T2;温度升高,化学平衡向正反应方向进行,生成物浓度增大,由于T1<T2,所以K(T1)<K(T2),故答案为:<、<;
③恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,
故答案为:不变;
(2)①从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-═2N2O5+2H+,
故答案为:N2O4+2HNO3-2e-═2N2O5+2H+;
②电解池阴极反应的离子有NO3-和H+,电解池工作原理可知,阳离子移向阴极,所以H+通过隔膜,方向为从左室移向右室,故答案为:H+,左室移向右室;
③阴极反应:NO3-+2H++e-=NO2↑+H2O,气体物质的量为
=1mol,转移电子物质的量为1mol,生成N2O5的电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,转移电子物质的量为1mol,生成1molN2O5,故答案为:1mol.
| c4(NO2)?c(O2) |
| c2(N2O5) |
| c4(NO2)?c(O2) |
| c2(N2O5) |
②△H>0,正反应方向吸热,即生成物浓度大,温度越高,T1和T2温度时,NO2浓度分别为2.48mol?L-1和4.98mol?L-1,后者高于前者,可知T1<T2;温度升高,化学平衡向正反应方向进行,生成物浓度增大,由于T1<T2,所以K(T1)<K(T2),故答案为:<、<;
③恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,
故答案为:不变;
(2)①从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-═2N2O5+2H+,
故答案为:N2O4+2HNO3-2e-═2N2O5+2H+;
②电解池阴极反应的离子有NO3-和H+,电解池工作原理可知,阳离子移向阴极,所以H+通过隔膜,方向为从左室移向右室,故答案为:H+,左室移向右室;
③阴极反应:NO3-+2H++e-=NO2↑+H2O,气体物质的量为
| 22.4L |
| 22.4L/mol |
点评:本题为拼合型,涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用、电解原理、溶度积的有关计算、离子浓度的比较等知识点,题量大,计算量较大.

练习册系列答案
相关题目
由硫酸钠和硫酸组成的混合液中,其c(H+)=0.2mol/L,c(SO42-)=0.3mol/L,则c(Na+)为( )
| A、0.3mol/L |
| B、0.15mol/L |
| C、0.2mol/L |
| D、0.4mol/L |
NA表示阿伏加德罗常数.下列说法正确的是( )
| A、0.1mol Na2O2中含有的阴离子数目为0.2NA |
| B、标准状况下,2.24L CHCl3的分子数为0.1NA |
| C、标准状况下,2.24L CHCl3的分子数为0.1NA |
| D、9.2g NO2和N2O4的混合气体中含有的氮原子数为0.2NA |
取三张蓝色石蕊试纸置于表面皿上,然后按顺序滴加65%的硝酸,98.3%的硫酸和新制氯水,三张试纸最终呈现的颜色是( )
| A、白 红 白 |
| B、白 黑 白 |
| C、红 红 红 |
| D、红 黑 红 |
在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是( )
| A、Na+、K+、MnO4-、SO42- |
| B、Cl-、Al3+、AlO2-、Na+ |
| C、Na+、CH3COO-、H+、K+ |
| D、K+、I-、Na+、Fe3+ |