题目内容
10.下列说法正确的是( )| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
分析 A.35Cl和37Cl的核外电子数均为17;
B.依据氢元素的三种同位素解答;
C.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质;
D.键长H-F<H-Cl,故H-F键键能更大.
解答 解:A.35Cl和37Cl的核外电子数均为17,它们的原子结构示意图相同,故A正确;
B.元素H有11H、21H和13H三种核素,故B错误;
C.元素周期表中位于金属元素和非金属元素分界线附近的元素具有金属和非金属的性质,可以作半导体材料,如Si,副族元素和第VIII族元素属于过渡元素,故C错误;
D.键长H-F<H-Cl,故H-F键键能更大,则断开1molH-F需要的能量更多,故D错误,
故选:A.
点评 本题为综合题,涉及常见元素的同位素、元素周期表、反应热,题目难度不大,掌握基础是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
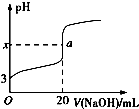
10.下列图象中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是( )
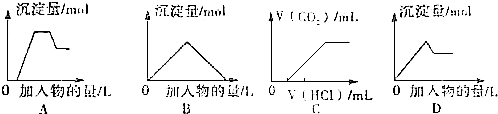

| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
1.下列反应能设计成原电池的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
5.常温下,不能与Al单质发生反应的是( )
| A. | CuSO4溶液 | B. | Fe2O3 | C. | 浓硫酸 | D. | NaOH溶液 |
2.下列有关化学用语表示正确的是( )
| A. | 过氧化钠的电子式: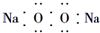 | |
| B. | 碳正离子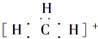 中质子数与电子数的比值为3:2 中质子数与电子数的比值为3:2 | |
| C. | 硫离子的结构示意图: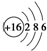 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: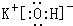 .
.
(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程: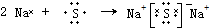 .
.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
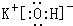 .
.(3)最高价氧化物是两性氧化物的元素是Al;
(4)用电子式表示元素④与⑥的化合物的形成过程:
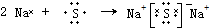 .
.  某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.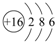 ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)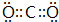 .
.