题目内容
16.下列表示物质或微粒的化学用语正确的是( )| A. | HF的电子式为 | B. | Mg2+的结构示意图为 | ||
| C. | CO2的电子式为: | D. | Cl-的结构示意图为 |
分析 A.HF为共价化合物,分子中不存在阴阳离子;
B.镁离子的核电荷数为12,最外层达到8电子稳定结构;
C.二氧化碳分子中含有两个碳氧双键,C原子最外层满足8电子稳定结构;
D.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构.
解答 解:A.氟化氢为共价化合物,氢原子与氟原子形成了一个共用电子对,氟化氢中氢原子最外层为2个电子,氟原子最外层达到8电子,用小黑点表示原子最外层电子,则氟化氢的电子式为 ,故A错误;
,故A错误;
B.Mg2+的质子数为12,核外电子数为10,离子结构示意图为: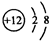 ,故B错误;
,故B错误;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D.氯离子的核电荷数为17,最外层满足8电子稳定结构,Cl-的结构示意图为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及电子式、离子结构示意图等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
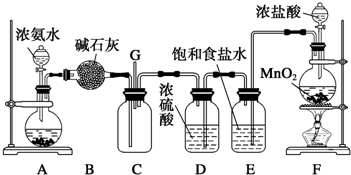
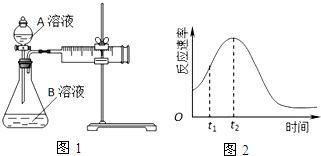
7.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表(KMnO4溶液已酸化),实验装置如图1:
(1)该反应的离子方程为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知H2C2O4是二元弱酸)
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
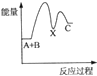
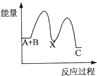
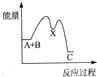
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.
4.草酸与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
(1)该反应中还原剂是H2C2O4.(填化学式)
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
现用4mL 0.001mol/L KMnO4溶液与2mL 0.01mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(2)对比实验I和II(用Ⅰ~Ⅳ表示,下同),可以研究催化剂对化学反应速率的影响;如果研究温度对化学反应速率的影响,对比实验I和III.
(3)对比实验Ⅰ和Ⅳ,可以研究硫酸的浓度(或氢离子的浓度)对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保对比实验中c(KMnO4)、c(H2C2O4)相同(溶液总体积相同).
1.下列反应能设计成原电池的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
8.除去下列物质中所含少量杂质(括号内为杂质),所选试剂和方法正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.常温下,不能与Al单质发生反应的是( )
| A. | CuSO4溶液 | B. | Fe2O3 | C. | 浓硫酸 | D. | NaOH溶液 |
6.下列各项所述的数字不是6的是( )
| A. | 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数 | |
| B. | 在二氧化硅晶体中,围成最小环的原子数 | |
| C. | 在金刚石晶体中,围成最小环的原子数 | |
| D. | 在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数 |