题目内容
10.使一定质量的锌与100mL 18.5mol•L-1浓硫酸充分反应.(1)若锌完全溶解,同时只生成SO2气体3.36L(标准状况下),求所得溶液中硫酸锌的物质的量浓度(假设反应前后溶液体积保持不变).
(2)若锌完全溶解,同时生成标准状况下混合气体为33.6L,并将反应后的溶液稀释至1L,测得溶液中c(H+)为1.0mol•L-1,求混合气体中各组分的体积比.
分析 (1)根据反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,结合相关数据进行计算;
(2)根据反应后溶液中氢离子浓度计算剩余硫酸的物质的量,假定气体A全部为二氧化硫,根据硫原子守恒计算二氧化硫的物质的量,与实际气体的物质的量比较判断气体的成分,据此解答.
解答 解:(1)标准状况下SO2气体3.36L,n(SO2)=$\frac{V}{{V}_{m}}$=$\frac{3.36L}{22.4L/mol}$=0.15mol,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,
1mol 1mol
0.15mol 0.15mol
则 n(ZnSO4)=0.150mol,c(ZnSO4)=$\frac{n}{V}$=$\frac{0.15mol}{0.1L}$=1.50mol•L-1
答:所得溶液中硫酸锌的物质的量浓度为1.50mol•L-1;
(2)反应后测得溶液c(H+)为1mol/L,则n剩余(H2SO4)=1mol/L×1L×$\frac{1}{2}$=0.5mol,假定气体A全部为二氧化硫,根据硫原子守恒可知,生成二氧化硫的物质的量=18.5mol/L×0.1L-0.5mol=1.8mol,实际气体A的物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,小于1.8mol,故生成气体为SO2、H2,
令SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑,
ymol ymol
故:x+y=1.5,2x+y=1.8,联立方程,解得:x=0.3,y=1.2
则:V(SO2):V(H2)=0.300mol:1.20mol=1:4
答:混合气体中V(SO2):V(H2)=0.300mol:1.20mol=1:4.
点评 本题考查根据方程式的有关计算,题目难度中等,(2)中判断气体的成分是解题关键.注意物质的量公式灵活运用.

| A. | 温度不变,增大A的物质的量,化学平衡右移 | |
| B. | 温度不变,增大B的浓度,V正增大,V逆减小,化学平衡右移 | |
| C. | 温度不变,减小C的浓度,V逆减小,V正减小,化学平衡右移 | |
| D. | 温度不变,增大D的浓度,同时增大B的浓度,化学平衡一定向左移动 |
| A. | 等浓度的三种溶液:醋酸钠溶液pH=a,碳酸氢钠溶液pH=b,碳酸钠溶液pH=c,则c>a>b | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH=7 | |
| C. | MgCl2溶液蒸发、结晶得MgCl2•6H2O | |
| D. | 常温下,若1mL pH=1盐酸与100mL NaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11 |
| A. | 草木灰不能与铵混合使用态氮肥 | B. | 铁在潮湿的环境下生锈 | ||
| C. | 加热氯化铁溶液颜色变深 | D. | 浓硫化钠溶液有臭味 |
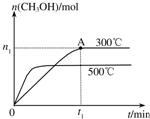 在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)?CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是( )| A. | 该反应的△H<0 | |
| B. | 其他条件不变,升高温度反应的平衡常数增大 | |
| C. | 300℃时,0-t1min内 CH3OH的平均生成速率为$\frac{{n}_{1}}{2{t}_{1}}$mol•L-1 min-1 | |
| D. | A点的反应体系从300℃升高到500℃,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
| A. | 利用NaOH溶液可以鉴别Al2(SO4)3、MgCl2和Fe2(SO4)3三种溶液 | |
| B. | 用焰色反应可以鉴别出NaCl和K2SO4两种无色溶液 | |
| C. | 用氢氧化钠溶液可以鉴别NH4Cl和NH4NO3两种物质 | |
| D. | 用丁达尔效应可以鉴别氢氧化铝胶体和氯化铝溶液 |
| A. | 将气体通过澄清石灰水 | B. | 将气体通过氯水 | ||
| C. | 将气体通过KMnO4溶液 | D. | 将气体通过饱和KHCO3溶液 |