题目内容
10.下列关于热化学反应的描述中正确的是( )| A. | NH4Cl 固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+566.0kJ/mol | |
| C. | 含1mol Ba(OH)2的溶液和含1molH2SO4的溶液反应放出的热量是中和热 | |
| D. | 1mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
分析 A.NH4Cl 固体和Ba(OH)2晶体在常温下的反应为吸热反应;
B.根据燃烧热计算;
C.反应还存在硫酸根离子和钡离子反应的反应热;
D.燃烧热指生产稳定氧化物时放出的热量.
解答 解:A.NH4Cl 固体和Ba(OH)2晶体在常温下的反应为吸热反应,故A错误;
B.CO(g)的燃烧热是283.0kJ/mol,则相同条件下2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,分解时吸热,反应的热化学方程式为2CO2(g)=2CO(g)+O2(g)的△H=+566.0kJ/mol,故B正确;
C.H2SO4和Ba(OH)2反应的反应热包括中和反应和硫酸根离子和钡离子反应的反应热,故C错误;
D.燃烧热指生产稳定氧化物时放出的热量,生成水蒸气不是液态,故D错误.
故选B.
点评 本题较为综合,涉及中和热、燃烧热、学反应的能量变化特征应用、反应条件的分析判断,题目难度不大,注意把握相关概念.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
18.下列说法或表示方法正确的是( )
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 甲基的电子式: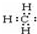 | |
| C. | 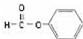 官能团为-COOH 官能团为-COOH | |
| D. | 4-甲基-3-乙基-2-己烯的结构简式为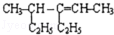 |
5.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
2.下列说法不正确的是( )
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为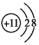 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
19.超临界流体是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂.下列有关超临界二氧化碳的说法中错误的是( )
| A. | 用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 | |
| B. | 超临界二氧化碳由CO2分子构成 | |
| C. | 用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去 | |
| D. | 超临界二氧化碳是新合成的一种物质 |
20.下列图象分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
| A. | 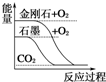 石墨转变成金刚石是吸热反应 | |
| B. | 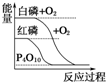 白磷比红磷稳定 | |
| C. | 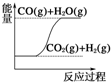 CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| D. | 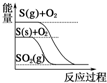 S(g)+O2(g)═SO 2(g)△H1 S(g)+O2((g)═SO2((g)△H2,则△H1>△H2 |