题目内容
11.下列比较中不正确的是( )| A. | 金属性:K>Na>Li | B. | 热稳定性:HI>HCl>HF | ||
| C. | 非金属性:F>O>N | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
分析 A.同一主族元素,元素的金属性随着原子序数增大而增强;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.同一周期元素,元素的非金属性随着原子序数增大而增强;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性K>Na>Li,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>I,所以氢化物的稳定性HF>HCl>HI,故B错误;
C.同一周期元素,元素的非金属性随着原子序数增大而增强,所以非金属性F>O>N,故C正确;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以碱性:NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素周期律内涵是解本题关键,知道金属性、非金属性强弱与其最高价氧化物的水化物酸碱性关系、非金属性和非金属性强弱判断方法是解本题关键,题目难度不大.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
2.下列说法不正确的是( )
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为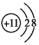 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
19.超临界流体是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂.下列有关超临界二氧化碳的说法中错误的是( )
| A. | 用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 | |
| B. | 超临界二氧化碳由CO2分子构成 | |
| C. | 用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去 | |
| D. | 超临界二氧化碳是新合成的一种物质 |
6.关于化学反应与能量的说法正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 需要加热的反应都是吸热反应 | |
| C. | 断裂化学键要吸收能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
16.下列容器不宜存放稀硫酸的是( )
| A. | 瓷制容器 | B. | 玻璃容器 | C. | 铁制容器 | D. | 铜制容器 |
3.已知丙烷的二氯代物有4种同分异构体,则六氯丙烷的同分异构体数目为( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.下列图象分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
| A. |  石墨转变成金刚石是吸热反应 | |
| B. |  白磷比红磷稳定 | |
| C. |  CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| D. |  S(g)+O2(g)═SO 2(g)△H1 S(g)+O2((g)═SO2((g)△H2,则△H1>△H2 |
1.下列物质性质递变正确的是( )
| A. | 原子半径:C、Al、K依次增大 | |
| B. | 热稳定性:HF、NH3、SiH4依次增大 | |
| C. | 水化物的酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱 | |
| D. | 非金属性:Cl、P、S依次增强 |