题目内容
在温度和压强不变时,1摩尔NO2放在体积为2升的密闭容器中高温条件下分解2NO2?2NO+O2,达到平衡时总的物质的量为1.3 摩尔,求:
(1)NO2的转化率为多少?
(2)此温度下该反应的化学平衡常数是多少?
(1)NO2的转化率为多少?
(2)此温度下该反应的化学平衡常数是多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:在温度和压强不变时,2NO2?2NO+O2,反应前后气体物质的量增加为生成氧气的物质的量,所以增加氧气物质的量0.3mol,生成NO0.6mo,消耗NO2物质的量0.6mol,列式计算转化率=
×100%,平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
| 消耗量 |
| 起始量 |
解答:
解:在温度和压强不变时,2NO2?2NO+O2,反应前后气体物质的量增加为生成氧气的物质的量,所以增加氧气物质的量=1.3mol-1mol=0.3mol,依据化学方程式计算得到生成NO为0.6mo,消耗NO2物质的量0.6mol,
(1)NO2转化率=
×100%=60%,答:NO2的转化率为60%;
(2)平衡时物质的浓度c(NO)=
=0.3mol/L,c(O2)=
mol/L=0.15mol/L,c(NO2)=
=0.2mol/L,反应的平衡常数k=
=
=0.34,
答:此温度下该反应的化学平衡常数是0.34.
(1)NO2转化率=
| 0.6mol |
| 1mol |
(2)平衡时物质的浓度c(NO)=
| 0.6mol |
| 2L |
| 0.3mol |
| 2L |
| 1mol-0.6mol |
| 2L |
| c2(NO)c(O2) |
| c2(NO2) |
| 0.32×0.15 |
| 0.22 |
答:此温度下该反应的化学平衡常数是0.34.
点评:本题考查了化学平衡计算,转化率、平衡常数概念的计算应用,注意反应特征的计算应用是关键,题目难度中等.

练习册系列答案
相关题目
下列叙述不正确的是( )
| A、实验剩余的任何药品不能放回原试剂瓶 |
| B、用规格为10mL的量筒量取6mL的液体 |
| C、使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内 |
| D、粗盐提纯操作的顺序是:溶解、过滤、蒸发、结晶 |
在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则反应消耗HNO3的物质的量为( )
| A、0.8mol |
| B、0.6mol |
| C、0.11mol |
| D、无法计算 |
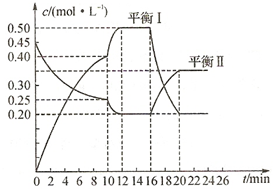 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应: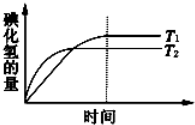 在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是
在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是