题目内容
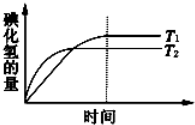 在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是
在密闭的容器中进行如下反应:H2(g)+I2(g)?2HI(g).在温度T1和T2时,产物的量与时间的关系如图所示,符合图象的正确判断是A.T1>T2,△H>0 B.T1<T2,△H<0
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:根据温度对平衡移动的影响分析,温度越高,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大.
解答:
解:温度越高,化学反应速率越大,达到平衡用的时间越少,曲线的斜率越大,所以T1<T2;
升高温度,化学平衡向吸热反应方向移动,产物的量降低,说明该反应向逆反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即正反应的△H<0;
故选B.
升高温度,化学平衡向吸热反应方向移动,产物的量降低,说明该反应向逆反应方向移动,所以逆反应方向是吸热反应,正反应是放热反应,即正反应的△H<0;
故选B.
点评:本题考查了化学平衡图象题的分析,难度中等,明确“先拐先平数值大”是解本题的关键,然后根据温度对化学平衡的影响分析反应热.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
医疗上常用难溶于水的硫酸钡作x射线透视肠胃的内服药剂,俗称“钡餐”.除去硫酸钡中混有的碳酸钡可选用的试剂是( )
| A、.蒸馏水 | B、.食盐水 |
| C、﹒氢氧化钠溶液 | D、.盐酸 |
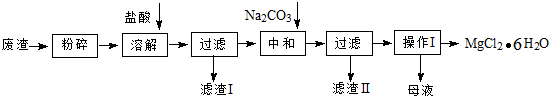
 X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题: