题目内容
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,现象和结论正确的是( )| 操作 | 现象 | 结论 | |
| A. | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B. | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C. | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.可能生成AgCl沉淀;
B.加入盐酸引入氯离子;
C.焰色反应为元素的性质,说明含有钠元素;
D.氨气极易溶于水.
解答 解:A.加入氯化钡,可能生成AgCl沉淀,如检验硫酸根离子,应先加入盐酸,如无现象,再加入氯化钡检验,如生成沉淀,可说明含有硫酸根离子,故A错误;
B.加入盐酸引入氯离子,应加入硝酸酸化,故B错误;
C.焰色反应为元素的性质,说明含有钠元素,可说明原溶液中有Na+,故C正确;
D.氨气极易溶于水,如检验是否有氨气生成,应用浓溶液,且加热,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,注意把握常见离子的鉴别方法,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
12.常用的锌锰干电池在放电时总反应可表示为:Zn+2NH4+═Zn2++2NH3+H2,则下列说法中正确的是( )
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池工作时,阳离子向负极移动 | |
| C. | 放电时Zn参与反应的电极为正极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
13.为了除氯化铵酸性溶液中的Fe3+,可加入一种试剂,该试剂是( )
| A. | 氢氧化钠 | B. | 硫酸 | C. | 氧化铜 | D. | 氨水 |
10.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入稀盐酸,产生无色无味且能使石灰水变浑浊的气体,该溶液一定含有CO32- | |
| B. | 用洁净的铂丝蘸取少量某溶液在无色火焰上灼烧,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中加入BaCl2溶液,有沉淀生成,再加入稀盐酸,沉淀不消失,该溶液一定含有SO42- | |
| D. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
7.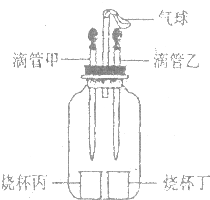 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
 如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )
如图所示装置(气密性良好),若先将甲中液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体挤出,气球又明显鼓起.下列组合正确的是( )| 选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
| A | 双氧水 | 二氧化锰 | 水 | 氢氧化钠 |
| B | 盐酸 | 镁 | 盐酸 | 碳酸纳 |
| C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
| D | 水 | 氧化钙 | 盐酸 | 镁 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验方法能达到实验目的是( )
| A. | 用淀粉溶液检验溶液中是否存在碘离子 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用排饱和食盐水集气法收集氯气 |
11.如图为某高效锂硫电池.关于该电池的说法正确的是( )


| A. | 电子流向:B电极→用电器→A电极→电解质→B电极 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 若用该电池在铁器上镀锌,电路中转移2 moI电子时,电镀池两电极质量差为65 g | |
| D. | 若用该电池电解精炼铜,负极减少7g时阳极减少质量为32 g |
12.某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )
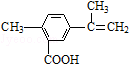

| A. | 在一定条件下,能发生取代、氧化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
 .
.