题目内容
12.常用的锌锰干电池在放电时总反应可表示为:Zn+2NH4+═Zn2++2NH3+H2,则下列说法中正确的是( )| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池工作时,阳离子向负极移动 | |
| C. | 放电时Zn参与反应的电极为正极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
分析 A.干电池工作时,电子从负极经外电路流向正极;
B.电池工作时,阳离子向正极移动,阴离子向负极移动;
C.失电子的电极作负极;
D.失电子的电极作负极,电极反应式为:Zn-2e-═Zn2+,据此计算.
解答 解:A.干电池工作时,电子从锌电极经外电路流向正极,故A错误;
B.电池工作时,阳离子向正极移动,阴离子向负极移动,故B错误;
C.锌失电子而作负极,碳棒为正极,故C错误;D.失电子的电极作负极,电极反应式为:Zn-2e-═Zn2+,外电路中每通过0.2 mol电子,锌的质量理论上减小0.1mol×65g/mol=6.5g,故D正确;
故选D.
点评 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
3.下列储存药品的方法中,正确的是( )
| A. | 氢氧化钠溶液盛装在玻璃塞的试剂瓶中 | |
| B. | 新制氯水保存在无色广口瓶中 | |
| C. | 铝片密封保存在细口瓶中 | |
| D. | 金属钠保存在煤油中 |
17.下列物质在熔融状态能导电且属于强电解质的是( )
| A. | 盐酸 | B. | 硫酸 | C. | BaSO4 | D. | NH3•H2O |
1.化学与科学、技术、社会、环境、生活密切相关.下列有关说法中错误的是( )
| A. | CCTV-8法兰琳卡护肤产品广告中“我们恨化学”严重违反科学,因其工艺肯定与化学有关 | |
| B. | 智能手机中使用的石墨烯不仅是电和热的良导体,还是硬度较大的新型有机合成材料 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | 为了能增加水中氧气的含量,养金鱼用的自来水一般先在阳光下晒一段时间 |
2.向四支试管中分别加入少量不同的无色溶液进行如下操作,现象和结论正确的是( )
| 操作 | 现象 | 结论 | |
| A. | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B. | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C. | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
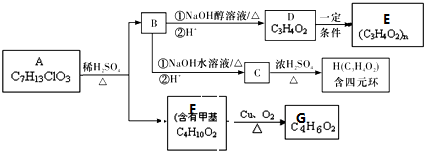
 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.