题目内容
8.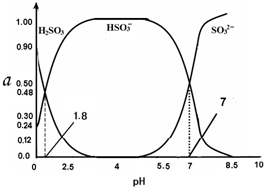 常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
分析 A.亚硫酸为二元弱酸,其电离分步进行;结合图象计算亚硫酸的Ka1;
B.根据亚硫酸溶液中的电荷守恒进行分析;
C.根据图象数据可知,pH=2.5时:c(HSO3-)>c(H2SO3);
D..溶液的pH=8.5时显碱性,所以c(OH-)>c(H+),根据图象知,溶液中含有的是SO32-,SO32-在溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,向上述体系中通入极少量 Cl2,发生反应HSO3-+Cl2+H2O═SO42-+3H++2Cl-,促进SO32-水解,据此判断c(HSO3-)和c(SO32-)的浓度变化.
解答 解:A.H2SO3是二元弱酸,在溶液中电离是分步进行的,亚硫酸的第一步电离方程式为:H2SO3?H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=$\frac{0.24×1}{0.9}$≈0.27,故A错误;
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+c(H+)•c(OH-),Kw=c(H+)•c(OH-),所以c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C.在pH=2.5该溶液中,根据图象曲线可知c(HSO3-)>c(H2SO3),正确的离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故C错误;
D.溶液的pH=8.5时显碱性,所以c(OH-)>c(H+),根据图象知,溶液中含有的是SO32-,SO32-在溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,向上述体系中通入极少量 Cl2,发生反应为:HSO3-+Cl2+H2O═SO42-+3H++2Cl-,促进SO32-水解,c(SO32-) 减小,而c(HSO3-)增大,故D错误;
故选B.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.

| A. | 肯定不含I- | B. | 不能确定是否含有SO42- | ||
| C. | 至少含有Na+、NH4+、K+中的两种 | D. | 可能含有Cu2+ |
| A. | 原子的质量几乎全部集中在原子核上 | |
| B. | 放射性同位素可以用于食物保鲜和肿瘤的治疗 | |
| C. | 在含有多个电子的原子里能量高的电子在离核较近的区域内运动 | |
| D. | ${\;}_{92}^{234}$、${\;}_{92}^{235}$U、${\;}_{92}^{238}$U三种核素互为同位素 |
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4(或K2CO3、Na2SO3) | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(2)写出实验室由⑩制备O2的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
| A. | 医用酒精是指质量分数为75%的乙醇溶液 | |
| B. | 用过滤的方法可以分离乙醇和乙酸乙酯 | |
| C. | 油脂、淀粉、纤维素、蛋白质都是高分子化合物 | |
| D. | 石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃 |
| A. | 23gNa与足量水反应中转移的电子数目为NA | |
| B. | 30g乙烷含有的共价键数目为8NA | |
| C. | 25℃,1.01×105 Pa下,使1 mol氯化氢气体溶于1 L水中,所得溶液的物质的量浓 度为1 mol•L-1 | |
| D. | 常温常压下,11.2LSO3含有的氧原子数为1.5NA |
| A. | Na | B. | Mg | C. | Al | D. | Fe |
| A. | 100mL1mol/L的氨水 | B. | 200mL1mol/L的NH4Cl | ||
| C. | 50mL0.5mol/L的CH3COONH4溶液 | D. | 50mL0.5mol/L的NH4NO3 |